概要
これらの資料は、うつ病とその治療法に関する情報を提供することを目的としています。 うつ病のモノアミン仮説、ストレスの役割、遺伝子と環境の相互作用、神経栄養因子、海馬の神経新生、物質離脱、概日リズム、うつ病の機能的解剖学など、うつ病の生物学的基礎に関する洞察を提供しています。 また、うつ病の段階的治療アルゴリズム、薬物療法(抗うつ薬の種類、投与、モニタリングを含む)、精神療法(認知行動療法、深層心理学に基づく療法および精神分析療法を含む)、ならびに睡眠不足や光療法などの支援策についても説明しています。 さらに、うつ病の重症度を評価するためのスケール、治療への反応を判断する方法、および精神科医への紹介の適応など、うつ病の管理に関する実用的なガイダンスを提供しています。 最後に、セントジョンズワートの使用に伴う潜在的なリスクと相互作用、ならびにうつ病の治療における患者教育と共同意思決定の重要性について強調しています。
----------
うつ病は通常の悲しみや喪失感情に関連していますが、これらの感情の外的原因が消失しても改善しないばかりか、その原因に比して過度に強いです。クラシックな重度のうつ病状態にはしばしば外的な誘因がありません。ただし、心理社会的な誘因がある場合とない場合のうつ病を明確に区別するのは難しいです。
- 大うつ病性障害の診断には、明確な気分の変化が必要であり、悲しみやイライラが特徴で、少なくとも睡眠や食欲、性欲の乱れ、便秘、仕事や友人との楽しみの喪失、泣きじゃくること、自殺の念、発話や行動の鈍化などのいくつかの心身の変化が伴います。これらの変化は少なくとも2週間持続し、仕事や家庭の関係にかなりの支障をきたします。この広義の定義に基づくと、アメリカではうつ病の生涯発症率は男性で12%以上、女性で20%以上になります。
- 一部の人々は、「メランコリア」または「生命力のうつ病」と呼ばれる重度のうつ病の狭義の定義を主張しています。
- 大うつ病の患者の中でごく少数が、過活動、高揚感、快楽追求の増加を伴う躁状態を経験しています。これらの症例と大うつ病性障害の一部の病因学的メカニズムが重なることがありますが、躁状態の歴史がある場合、それは躁うつ病という独自の疾患を定義します。
- うつ病は非均質な障害であり、その経過は非常に変動が大きく、治療への反応も一貫しておらず、確立されたメカニズムもありません。このレビューでは、大うつ病の生物学的メカニズムを理解するための主要な現在のアプローチを紹介します。
遺伝学
一卵性双生児と二卵性双生児の間で大うつ病の一致率を比較した研究から、その遺伝性は約37%と推定されています。これは躁うつ病や統合失調症の遺伝性よりもはるかに低いです。また、正常な人格の一部である危害回避、不安、および悲観主義なども部分的に遺伝的です。ケンドラーらによる研究によれば、うつ病は部分的には遺伝的にうつ病傾向の人格特性に起因するが、人格とは独立した遺伝的要因によるものでもあることが示されています。早発性、重度、反復性のうつ病は他の形態よりも高い遺伝性を持つことがあります。家族研究から明らかになっていることは、大うつ病は単一の遺伝子によって引き起こされるわけではなく、複雑な遺伝的特徴を持つ疾患であるということです。大うつ病の多発する系譜の研究では、この疾患にリンクする染色体領域が特定され、いくつかの研究でこれらの遺伝子座が再現されていますが、全ての家族研究で同じ染色体領域が再現されたわけではありません。ホルマンズらは、再発性の早発性うつ病が染色体15q25-q26にリンクする証拠を見つけましたが、人口の負担可能リスクは小さかったです。
具体的な分子的リスク因子は確実に特定されていません。セロトニン輸送体遺伝子のプロモーターを影響するセロトニン輸送体連関多型領域(5-HTTLPR)の一般的な多型変異は、脳のプレシナプス細胞での神経伝達物質セロトニンの取り込みを減少させます。この多型変異がうつ病の発症を促進するとする研究もありますが、同時に不安や悲観的な人格への傾向も促進するとされています。脳の画像診断は、5-HTTLPRの異なる一般的な多型変異を保持する人々において、感情関連領域での機能的な違いを示していますが、うつ病との直接的な関連性は不明です。大規模で前向きな流行病学的研究では、カスピらは、5-HTTLPRが特定の生活ストレスと関連してうつ病を予測することを見出しました。一部の環境要因は、ゲノムにエピジェネティックに影響を与えることでうつ病に対する感受性を与える可能性があります — たとえば、ネズミでの増加した母性ケアは、グルココルチコイド受容体遺伝子のプロモーター領域にエピジェネティックな変化を引き起こします。
モノアミン欠乏仮説
ノルアドレナリンおよびセロトニン系は脳深部に起源を持ち、脳全体に広がり、感情、思考、行動の多くの領域を調整する能力を示しています。初期の抗うつ薬はノルアドレナリンとセロトニンの再取り込みを阻害しました。この薬理作用の直接的な効果は、シナプス内でのノルアドレナリンとセロトニンの利用可能性を増加させ、投射後ニューロンの刺激を増加させることです。モノアミン酸化酵素の阻害剤も抗うつ薬作用を持つことが発見されました。この酵素はそれぞれのプレシナプスニューロンでノルアドレナリンとセロトニンを分解し、その阻害は神経伝達物質の利用可能性を増加させることが期待されます。これらの発見は、モノアミン欠乏仮説として知られるうつ病の主要な理論を生み出しました。血漿、尿、脳脊髄液中のノルアドレナリンおよびセロトニン代謝産物の多数の研究、およびうつ病患者の脳の死後研究は、まだその欠乏を確実に特定していません。ただし、脳特異的な酵素トリプトファンヒドロキシラーゼの新しい形態であるTPH-2が発見され、これは以前の死後研究がうつ病患者と対照群の間でトリプトファンヒドロキシラーゼ活性の違いを示さなかった理由を説明できるかもしれません。最近の陽電子放射断層撮影研究は、脳モノアミン酸化酵素のリガンドを使用し、うつ病患者の一部で酵素の30%増加を示しました。うつ病患者と対照群との間でのノルアドレナリン代謝産物の違いを測定する研究は、内頸静脈と腕動脈の間で脳によるノルアドレナリン代謝産物の低産生を示しました。モノアミン欠乏仮説は、新しい技術が脳に窓を開くたびに研究を刺激し続けています。
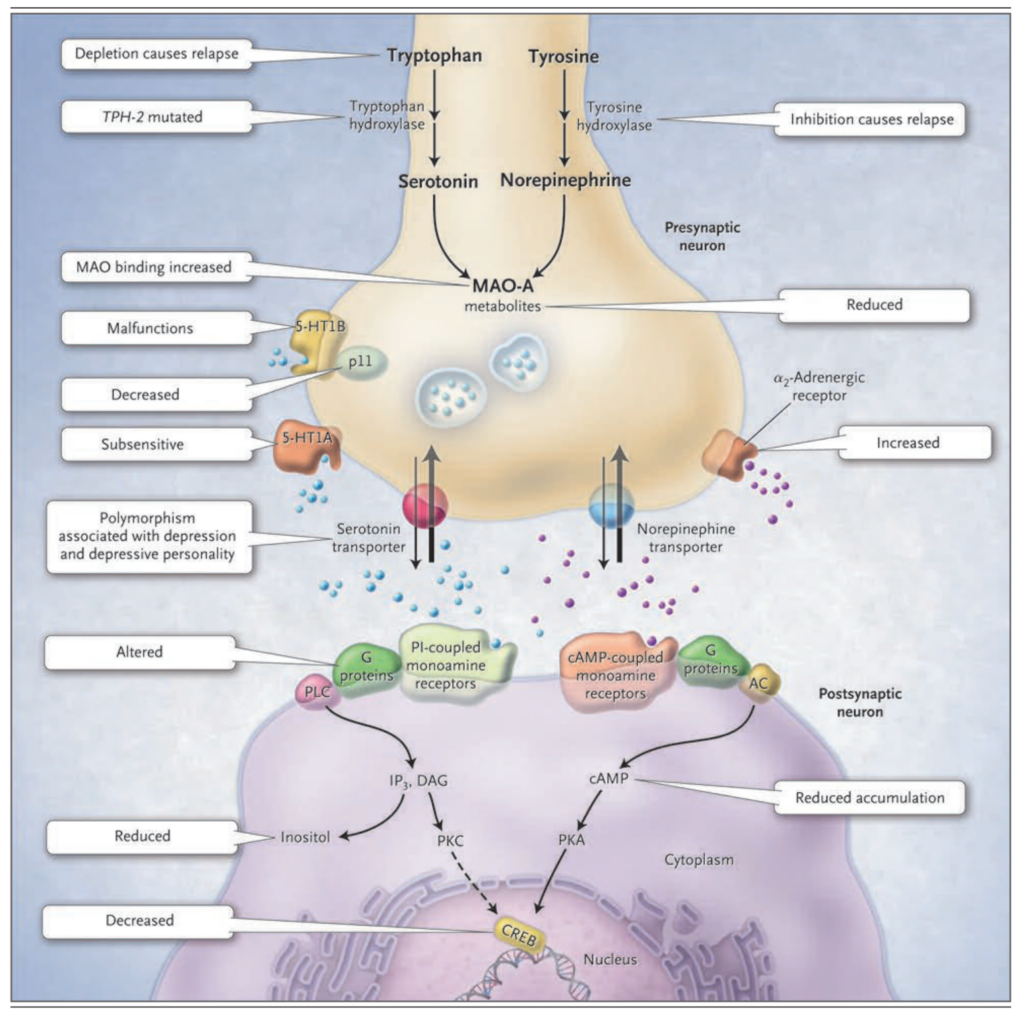
図1(対面ページ)。モノアミン欠乏仮説の拡張。
うつ病のモノアミン仮説は、脳内でのセロトニンまたはノルアドレナリンの神経伝達の欠乏を仮定しています。モノアミン作動性神経伝達は、セロトニン(5-ヒドロキシトリプタミン1A [5-HT1A] 及び 5-ヒドロキシトリプタミン1B [5-HT1B])またはノルアドレナリン(ノルアドレナリン)が、プレシナプスニューロンから放出されます(左側に示されるセロトニン作動性ニューロンと、右側に縮小して仮想的に示されるノルアドレナリン作動性ニューロン)。セロトニンはトリプトファンから合成され、合成経路の最初の段階はトリプトファンヒドロキシラーゼによって触媒されます。ノルアドレナリンはチロシンから合成され、合成経路の最初の段階はチロシンヒドロキシラーゼによって触媒されます。両方のモノアミントランスミッターは、プレシナプスニューロンの小胞に貯蔵され、シナプス間隙に放出され、それによってプレシナプスとポストシナプスの両方のニューロンに影響を与えます。神経伝達物質のシナプスにおける作用の停止は、特定のセロトニンおよびノルアドレナリントランスポーターを介した再取り込みと、セロトニンの場合はプレシナプス5-HT1Aおよび5-HT1B調節オートレセプター、ノルアドレナリンの場合はα2-ノルアドレナリン調節オートレセプターを介したフィードバック制御によって行われます。モノアミン酸化酵素A(MAO-A)はプレシナプスでモノアミンを分解し、それによって間接的に小胞の内容物を調整します。5-HT1B受容体と相互作用するp11タンパク質は、その機能を増加させます。ポストシナプスでは、セロトニンとノルアドレナリンは、2種類のグアニンヌクレオチドトリリン酸結合タンパク質(Gタンパク質)共役受容体に結合します:環状AMP(cAMP)共役受容体はアデニル酸シクラーゼ(AC)を活性化してcAMPを生成し、リン脂質C(PLC)共役受容体はホスホリパーゼC(PLC)を活性化してイノシトール三リン酸(IP3)とジアシルグリセロール(DAG)を生成します。cAMPはプロテインキナーゼA(PKA)を活性化し、IP3とDAGはプロテインキナーゼC(PKC)を活性化します。これらの2つのプロテインキナーゼはcAMP応答要素結合タンパク質(CREB)に影響を与えます。うつ病患者での研究結果は、チロシンヒドロキシラーゼの阻害や食事中のトリプトファンの枯渇によるうつ病の再発、脳特異的なトリプトファンヒドロキシラーゼ(TPH-2)に影響を及ぼす突然変異の頻度の増加、MAO-Aへの特異的なリガンド結合の増加、低感作な5-HT1A受容体、機能不全の5-HT1B受容体、p11の減少、うつ病と関連のあるセロトニン再取り込みトランスポーターの多型、神経伝達物質の信号に対するGタンパク質の不十分な反応、そして死後脳でのcAMP、イノシトール、CREBの低レベルなどをサポートしています。
ストレス、視床下部-下垂体-副腎軸、および成長因子
ストレス49は脳の皮質によって知覚され、視床下部に伝達され、そこで副腎皮質刺激ホルモン(CRH)が下垂体受容体に放出されます。この刺激により、コルチコトロピンが血漿中に分泌され、副腎皮質のコルチコトロピン受容体が刺激され、コルチゾールが血液中に放出されます。視床下部のコルチゾール受容体は、ホメオスタシスを維持するためにCRHの産生を減少させることで応答します(図2)。
コルチゾールおよびその中枢放出因子であるCRHがうつ病に関与しているという証拠が多数あります50,51。うつ病の患者では、血漿中のコルチゾールレベルが上昇し38、脳脊髄液中のCRHレベルが上昇し50、脳の辺縁領域でCRHメッセンジャーRNAおよびタンパク質のレベルが増加することがあります50。デキサメタゾンを使用して、CRH放出のシャットダウンのための視床下部のフィードバック信号への感受性を評価する研究では、最も重症のうつ病患者の約半数で通常のコルチゾール抑制反応が欠如しています52。抗うつ薬による臨床寛解は、これらの異常の一部が逆転するとともに伴います52。
幼少期に身体的または性的虐待の歴史がある成人は、脳脊髄液中のCRHレベルが増加しています53。母親から離されたり幼獣として虐待されたネズミでは、強制泳動試験での運動不能が増加し、これは抗うつ薬治療によって逆転します54。成人期に特定の領域でグルココルチコイド受容体がノックアウトされたマウスでは、視床下部-下垂体-副腎軸の活性が増加し、強制泳動試験での運動不能が増加しますが、これらも抗うつ薬によって逆転します55。シナプス間のモノアミンの増加は視床下部-下垂体-副腎軸に影響を与え、ストレスの長期的な影響の一部を逆転させます56。抗うつ薬が広範な精神疾患、パニック障害、心的外傷後ストレス障害、過食症、月経前症候群、強迫性障害を含むさまざまな精神疾患に対して一般的に有用である理由を、抗ストレスメカニズムが説明することができます。CRH受容体拮抗薬は動物モデルで抗うつ活性を示します57が、大規模な臨床試験の結果は期待外れでした。グルココルチコイド受容体をブロックする化合物がうつ病で効果的であると報告されていますが、その対象は最も重症で精神病性のタイプに限られます58。
血液中のコルチゾールレベルを単一のテストで測定することは、うつ病の診断に貢献しません。なぜなら、コルチゾールのレベルは昼夜リズムで大幅に変動し38、患者と対照群との間の値の重なりがかなりあるからです。精神的な算数や模擬された公のスピーチなど、実験室で誘発された軽度のストレスは、うつ病患者と対照群の間の値の大部分の差よりも、血漿コルチゾールレベルにより大きな変化を引き起こします38。
うつ病における夜間特にコルチゾールの慢性的な軽度の上昇が、病原性の役割を果たす可能性があります。また、末梢のコルチゾール上昇は、環境ストレスが気分に及ぼす影響を伝達するCRHシグナリングの中央の障害の反映にすぎない可能性もあります59。
視床下部-下垂体-副腎軸理論におけるうつ病の主な問題は、ストレスとうつ病との関係を定義することの難しさです。一部の患者は一生に一度のうつ病エピソードを経験しますが、より多くの割合の患者は反復的またはさらには慢性的な経過をたどります。急性ストレスのさまざまなタイプ、幼少期のトラウマ、または長期の心理社会的問題が関与しており、ストレスシステムの反応も異なる可能性があります。ストレスがいくつかのケースで原因となり、他のケースではうつ病的気分の二次的結果となることがあります。
ネズミにおいては、重度のストレスが幼少期の一般的なストレスをモデル化するわけではありません。幼少期に虐待があり成人期に心理病理学的障害、うつ病を含む疾患が関連していることは、虐待者とその被害者との間で共有される遺伝子だけでなく、貧困、栄養不良、および不適切な出生前ケアなどの共有環境にも起因する可能性があります。うつ病は、心理社会的リスク因子のない人々にも珍しくありません。うつ病治療を受けるほとんどの患者には視床下部-下垂体-副腎軸の機能障害の証拠がないのと同様に、ほとんどの患者には脳モノアミン欠乏の直接的証拠がありません。
成人哺乳類の脳では通常、ニューロンは分裂しませんが、多くの研究でニューロジェネシスが脳の複数の領域、特に海馬で起こることが示されています。ニューロジェネシスは霊長類よりもネズミで顕著であり60、人間の皮質で起こるかどうかについては疑問視する研究もあります61。
グルココルチコイドの増加は神経新生を減少させる可能性があり、これがうつ病患者の多くの患者の脳の磁気共鳴画像での海馬の縮小のメカニズムとして示唆されています62。うつ病患者の死後の研究では、亜前頭皮質での細胞喪失、側頭前皮質および眼窩前頭皮質での萎縮、視床下部およびドルサルラフヌクレウスでの細胞数の増加が報告されています63。これらの影響は、クッシング病患者の脳での萎縮変化とも類似しています64、またグルココルチコイドで処理されたネズミでも見られます65。ただし、うつ病のコルチゾール上昇はクッシング病ほど高くありません。
小さな容器での拘束はネズミにストレスを誘発し、神経新生を抑制しますが、抗うつ薬治療によってこの効果は打ち消されます66。抗うつ薬は非人間プライメートでの神経新生も促進します67。Santarelliら68はマウスで海馬に単一の両側インフュージョンを行い、神経新生を廃止しました。彼らは放射線もまた動物が強制泳動試験で抗うつ薬治療に対して行動的に応答する能力を廃止すると発見しましたが、この現象は研究されたすべてのマウス株で起こるわけではありません69。HennとVollmayrは、神経新生の減少がストレスと不安の結果であるが、行動的には関連しない可能性があることを示す他の研究をまとめました70。神経新生の動物モデルの関連性は、脳卒中の神経保護戦略の研究との類似性によって疑問視されています。動物モデルでの多くの発見が人間の研究で複製されていないのと同様です71。
神経栄養因子である脳由来神経栄養因子(BDNF)は、軸索成長、ニューロンの生存、およびシナプス可塑性にとって重要です72。ストレス73やコルチゾール74がBDNFのレベルに影響を与えます。自殺したうつ病患者の死後の研究では、BDNFが海馬で減少していることが示されています75。抗うつ薬と電気けいれん療法は、BDNFおよび他の神経栄養因子の発現を上昇させます75,76。BDNFを歯状回に単一の双側インフュージョンすると、抗うつ薬のような効果が得られます77。1つの研究では、BDNF met166アリルを保持するうつ病患者の海馬が正常よりも小さかったことが示されています78。うつ病の動物モデルでは、エピジェネティックヒストンメチル化がBDNFトランスクリプトのダウンレギュレーションを仲介し、抗うつ薬治療がこの効果を逆転させることが示されています79。これらの研究は、BDNFがストレス、神経新生、およびうつ病における海馬萎縮のリンクであると示唆しています。ただし、BDNF val166met多型の遺伝学的関連性はほとんどの研究で複製されておらず74、BDNFはうつ病に限らず多くの精神疾患に関連している可能性があります74。BDNFノックアウトマウスはうつ病とは無関係の行動を示します45。うつ
病患者の末梢血中のBDNFレベルの低下は、ほとんどが血小板からのものであることがほぼ完全にわかっています80。この結果を解釈する際には多くのアーティファクトが考慮される必要があります。脳の炎症と一部の神経毒素は脳のBDNFレベルを増加させ、BDNFの作用が一様に治療的ではないことを示唆しています81。Castrén82は、抗うつ薬治療がシナプス分枝を増加させ、脳が環境からの入力をより効果的に利用してうつ病から回復するのを可能にすると提案しています。この仮説は認知がうつ病において果たす役割を強調し、生化学的メカニズムが非特異的である可能性を示唆しています。
強力な流行病学的データは、大うつ病障害と増加した心血管モルビディティおよび死亡率との関連を示しています83。多くの患者では、心血管障害がうつ病よりも先行し、他の患者ではうつ病が心血管障害よりも先行します。n−3脂肪酸欠乏84および増加した血漿ホモシステインレベル85が心血管疾患およびうつ病に関与しているとされています。うつ病におけるコルチゾールの増加は、腹部脂肪を増加させることで冠動脈疾患のリスクを増加させる可能性があります64,86。抗うつ薬治療は、冠動脈閉塞後にうつ病を発症した患者の生存率を向上させます86。脳神経新生において内皮細胞のシグナリングは重要な役割を果たし87、これらの細胞はBDNFを分泌します。したがって、うつ病および心血管疾患は内皮障害の例である可能性があります。主要なうつ病と心血管疾患に炎症過程の兆候が記載されています88。一部のデータは、運動がうつ病において保護的または治療的な効果を有する可能性を示唆しています89。ネズミのモデルもこの可能性を支持しています90。
表1. マウスのうつ病関連行動に影響を与えるモノアミン関連遺伝子ノックアウト
| 遺伝子またはタンパク質 | 機能 | うつ病関連の変化 | モノアミン欠乏仮説の裏付け | 遺伝子ノックアウトによって引き起こされる他の行動 |
|---|---|---|---|---|
| sert セロトニン輸送体 | うつ病行動の増加、セロトニンレベルの減少、シナプス後5-HT1ARの感受性低下、シナプス前5-HT1AR機能の低下 | いいえ | 過剰な不安 | |
| net ノルエピネフリン輸送体 | うつ病行動の減少、ノルエピネフリン除去の遅延、細胞外ノルエピネフリンレベルの上昇 | はい | アンフェタミンおよびコカインへの運動反応の増加 | |
| 5-ht1ar セロトニン1A受容体(シナプス前自己受容体およびシナプス後受容体) | うつ病行動の減少、正常なセロトニンレベルおよび放出、SSRI誘発神経新生の障害 | いいえ | 過剰な不安、海馬学習の障害 | |
| 5-ht1br セロトニン1B受容体(シナプス前自己受容体およびシナプス後受容体) | 強制水泳試験におけるSSRIへの反応の減少、セロトニンレベルの減少およびセロトニン放出の増加、SSRI誘発セロトニン放出の増加、セロトニン輸送体の発現の減少 | はい | 攻撃性の増加、不安の減少、探索行動の増加、コカインの使用の増加 | |
| p11(タンパク質) 5-HT1BRのシグナル効率を強化 | うつ病行動の増加、セロトニン代謝回転の増加 | いいえ | 報告なし | |
| 5-ht2ar セロトニン2A受容体 | 変化なし | いいえ | 対立不安パラダイムにおける抑制の減少 | |
| 5-ht7 セロトニン7受容体(おそらくシナプス前自己受容体およびシナプス後受容体) | うつ病行動およびREM睡眠時間の減少 | いいえ | 通常の運動行動 | |
| α2aar α2Aアドレナリン受容体(シナプス前自己受容体) | ノルエピネフリンレベルの減少、シナプス前の放出の抑制、うつ病行動の増加 | いいえ | 交感神経調節の変化、運動協調性の障害 | |
| α2car α2cアドレナリン受容体(中枢神経系に限定されたシナプス前自己受容体) | うつ病行動の減少 | はい | 攻撃性の増加、アンフェタミンに対する運動反応の増加 | |
| mao-a モノアミン酸化酵素A | 脳内のセロトニンおよびエピネフリンレベルの増加 | いいえ | 攻撃性およびストレス反応の増加、探索行動の減少 | |
| ac VII(ヘテロ接合体) アデニル酸シクラーゼタイプ7 | うつ病行動の減少 | いいえ | 不安の変化なし | |
| impa1 イノシトールモノホスファターゼ1 | うつ病行動の減少、脳内イノシトールレベルの変化なし | はい | 過活動およびピロカルピン誘発発作に対する感受性の増加 | |
| smit1 ナトリウム-ミオイノシトール輸送体1 | うつ病行動および脳内イノシトールレベルの減少 | はい | ピロカルピン誘発発作に対する感受性の増加 | |
| creb サイクリックAMP応答要素結合タンパク質 | うつ病行動の減少、抗うつ薬誘発行動の正常化 | いいえ | 抗うつ薬の長期使用後のBDNFの増加なし | |
| bdnf 脳由来神経栄養因子 | うつ病行動なし | いいえ | 攻撃性の増加、過食症、過活動 | |
| 男性マウス | 脳由来神経栄養因子 | うつ病行動の増加 | はい | 攻撃性の増加、過食症 |
- BDNFは脳由来神経栄養因子、5-HT1ARは5-ヒドロキシトリプタミン1A受容体、5-HT1BRは5-ヒドロキシトリプタミン1B受容体、REMは急速眼球運動、SSRIは選択的セロトニン再取り込み阻害薬を示します。
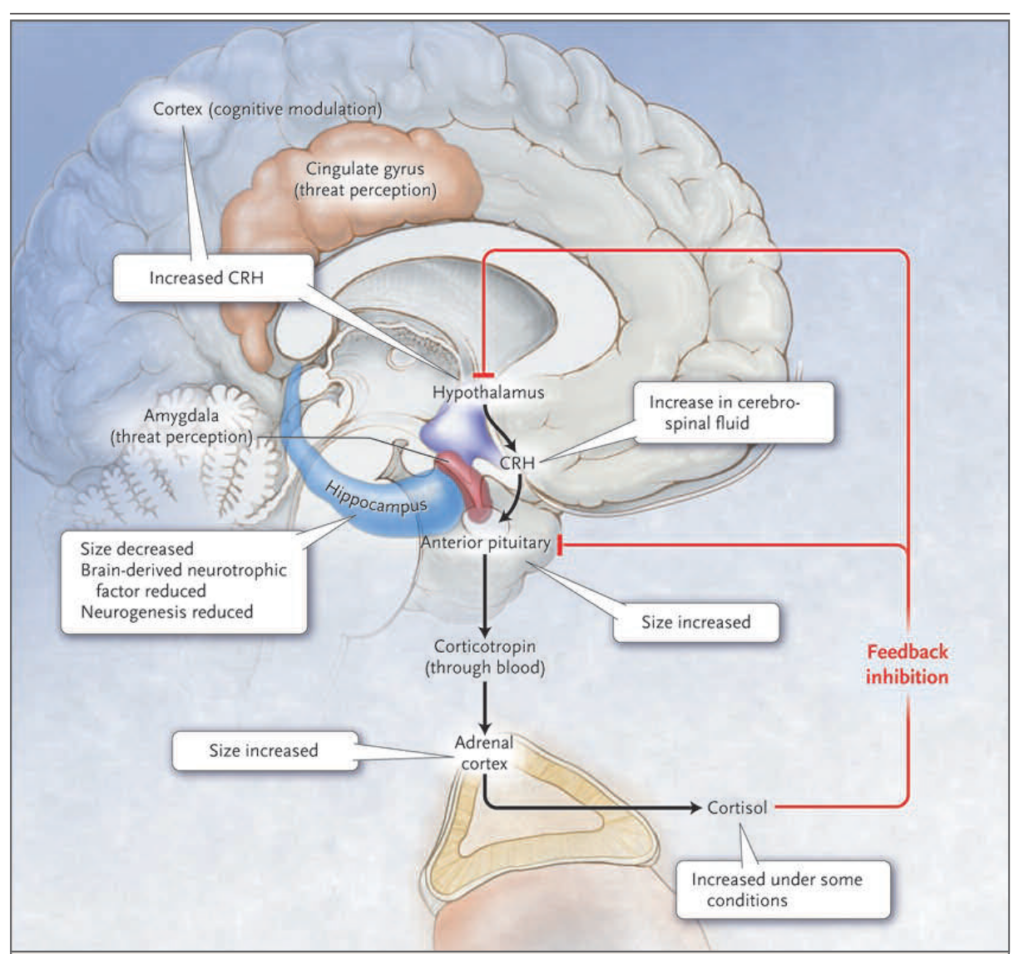
図2. うつ病における視床下部-下垂体-コルチゾール系
うつ病の視床下部-下垂体-コルチゾール仮説は、ストレスに対するコルチゾール反応の異常がうつ病の根底にある可能性を示唆しています。黒い矢印は、ストレスに対する反応として、脳の皮質および扁桃体によって認識され、視床下部に伝達されると、コルチコトロピン放出ホルモン(CRH)が放出されることを示しています。これにより、前部下垂体腺が血流中にコルチコトロピンを分泌します。コルチコトロピンは、副腎皮質を刺激してグルココルチコイドホルモンであるコルチゾールを分泌させます。赤い線は、コルチゾールが視床下部および下垂体にフィードバック抑制を誘導し、それぞれCRHおよびコルチコトロピンの産生を抑制することを示しています。
うつ病患者の研究結果で視床下部-下垂体-コルチゾール仮説を支持するものには、以下が含まれます。コルチゾールレベルが重度のうつ病では時折増加している、前部下垂体および副腎皮質のサイズが増加している、脳脊髄液中のCRHレベルおよび辺縁系脳領域でのCRH発現が増加している。海馬のサイズおよび神経細胞とグリア細胞の数が減少している。これは、コルチゾールレベルの上昇や脳由来神経栄養因子の減少による神経新生の減少を反映している可能性があります。
表2. うつ病の病態生理に関するその他の生物学的理論
| 理論 | 支持する証拠 | 矛盾する証拠 |
|---|---|---|
| グルタミン酸神経伝達の変化 | 前頭前野のグルタミン酸およびグルタミンレベルの低下91 静脈内ケタミン(NMDA拮抗薬)は迅速かつ持続的な抗うつ効果をもたらす94 ケタミンは高親和性状態のD2ドーパミン受容体に結合95 グルタミン酸輸送体およびグルタミン酸をグルタミンに変換する酵素の皮質メッセンジャーRNAレベルの低下96 | 後頭皮質のグルタミン酸レベルが上昇92,93 抗うつ薬が脳内AMPA受容体に影響を与えるかは不明97 |
| GABA作動性神経伝達の減少 | 血漿、脳脊髄液、背外側前頭前皮質および後頭皮質のGABAレベルの低下91-93 GABAは脳シナプスの30%以上に存在し、特異性がないことを示唆 GABA調節薬は動物モデルで抗うつ効果を示す98 抗うつ薬はGABA作動性機能に影響を与える98 前頭前皮質のGABA神経免疫反応性が減少100 | MRSにおいて、うつ病で前頭前皮質のGABAレベルに差がない99 GABA神経伝達はうつ病における不安症状と関連している可能性がある |
| 異常な概日リズム | 睡眠不足および光療法が抗うつ効果を持つ101,102 一部のうつ病患者は気分、睡眠、体温および神経内分泌分泌の概日異常を持つ104 昼間に活動的な齧歯類は日照時間が短縮するとうつ病になる105 | 時計関連遺伝子とうつ病の関連性は一貫していない103 |
| 神経ステロイド合成の欠陥 | うつ病時の血漿および脳内コレステロールレベルの低下106 DHEAはうつ病患者に抗うつ効果を持つ108 | 統合失調症の所見も同様107 神経ステロイド(神経伝達物質受容体を調節する脳内活性ステロイド)は主に記憶と睡眠に影響 |
| 内因性オピオイド機能の障害 | δ-オピオイド受容体作動薬は齧歯類で抗うつ様効果を示し、脳内BDNFレベルを上昇させる109 皮質のμ-オピオイド受容体結合能力は持続的な悲しみに応じて減少111 | 初期報告ではオピオイドがうつ病治療に有効である可能性が示唆されたが、大規模なランダム化比較試験のデータは欠如している110 |
| モノアミン-アセチルコリン不均衡 | フィゾスチグミン(アセチルコリンエステラーゼ阻害薬)の投与によりヒトで抑うつ気分を誘発112 メカミラミン(ニコチン性アセチルコリン受容体拮抗薬)はうつ病症状を軽減113 ニコチン性アセチルコリン受容体拮抗薬は抗うつ薬の効果を増強114 | 多くの抗うつ薬は抗コリン作用を持たない |
| 免疫系と脳の間のサイトカイン媒介クロストーク | 感染症および自己免疫疾患ではうつ病が一般的115 サイトカイン曝露は抑うつ症状を誘発し、重度のうつ病ではサイトカイン分泌が増加115 抗うつ薬は抗炎症作用を持つ115 サイトカインは視床下部-下垂体-副腎系およびモノアミンに影響を与える115 | ほとんどの研究は相関的116 サイトカイン誘発抑うつ症状は一時的であり、すべての研究で再現されているわけではない117 サブスタンスP拮抗薬はうつ病に治療効果がない |
| チロキシン異常 | うつ病患者の脳脊髄液中のトランスサイレチンレベルの低下118 甲状腺ホルモンは脳のセロトニン作動系を調節119 三ヨードサイロニンの反応率はうつ病時に増加121 | チロキシン単独療法は効果がない 甲状腺機能低下症はほとんどのうつ病患者に現れない120 甲状腺機能低下症の成人ラットにチロキシンを投与すると脳の神経新生が減少 |
| 特定の脳構造および回路の機能障害 | 前頭前皮質の経頭蓋磁気刺激122および前帯状回の深部脳刺激が気分に影響を与える123 前頭前皮質124および下前頭前皮質125のグルコース使用が減少 ラットのうつ病モデルでは海馬の回路動態が変化127 | 研究ごとに関連する脳領域が異なる 血流、体積、グルコース利用および剖検方法論に関する所見が一貫していない63,124,126 |
*AMPAはα-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸、BDNFは脳由来神経栄養因子、DHEAはデヒドロエピアンドロステロン、GABAはγ-アミノ酪酸、MRSは磁気共鳴分光法を示します。
その他の可能なメカニズム
表2は、モノアミン欠乏仮説やストレス、コルチゾール、神経新生の役割に基づかない、うつ病の病態生理的メカニズムの可能性を要約しています。これらの他の提案されたメカニズムの多くは、うつ病以外の精神障害や神経障害にも関与しているとされています。脳の構成要素は高度に相互接続されているため、さまざまな理論の間で統合的なフレームワークを見つけるのはそれほど難しくありません。しかし、帰無仮説を拒否できるような形で理論を検証することは、より困難です。うつ病研究は時として、神経新生、グルタミン酸神経伝達、ニコチン受容体などの関連分野の支配的なアイデアを模倣する形で順次行われることがあり、独自の道を進むことが難しい状況にあります。
まとめ
うつ病をモノアミン枯渇型(神経伝達に関与する酵素をコードする遺伝子に関連している可能性がある)や、コルチゾール関連型(長期的な経過、海馬の萎縮、心理社会的ストレスの歴史を特徴とする)に分類しようとする試みは魅力的です。しかし、臨床データはそのような単純なカテゴリに収まらないことが多いです。モノアミン系抗うつ薬は、デキサメタゾン投与後もコルチゾールレベルが高い重度のうつ病患者に最も効果的です。
重度のうつ病には複数の原因がある可能性が高いです。中年または高齢のうつ病患者は、内皮機能障害に起因する心血管疾患に関連する障害を持っているかもしれません128。10代後半から20代前半の重度のうつ病患者は、重要な遺伝的リスク因子や躁病エピソードの高いリスクを持つことがあります8。不安や抑うつ的な性格を持つ患者では、遺伝的に決定された性格因子や不利な幼少期の経験が原因でうつ病になることがあります11,129。
うつ病のメカニズムに関するどの科学理論にも早急に決めつけないことが、新しい、より効果的な治療法を見つけるためには最善です。急性うつ病の病因は、長期的な機能と認知の低下を特徴とする再発性または慢性うつ病の病因とは異なる可能性があります。気分は(刺激薬46、脳刺激123、ケタミン94によって)一時的に上昇することもあれば、(回復した患者でのモノアミン枯渇19によって)低下することもありますが、長期的な改善には、ストレスによって誘発される異常なグルココルチコイド機能の減少や脳由来神経栄養因子の増加が必要かもしれません。
この論文に関連する利益相反は報告されていません。
私たちは、30年間にわたりうつ病に関する研究を奨励してくれたHerman van Praagに感謝します。
2つ目の論文
Depression research: where are we now?Saebom Lee, Jaehoon Jeong, Yongdo Kwak, Sang Ki Park*
抄録
広範な研究により、うつ病や関連する気分障害の分子基盤に関するさまざまな仮説が提唱されてきましたが、明確な病因メカニズムはまだ定義されていません。モノアミン仮説は、モノアミン系を標的とする抗うつ薬の有効性とともに、長い間うつ病研究の中心的なテーマでした。抗うつ薬の効果の開始がモノアミン系の急性変化を伴う可能性が広く認められている一方で、現在の研究の焦点は、慢性抗うつ薬治療後に脳内で生じる長期的な下流変化の分子メカニズムに向かっています。これにより、うつ病や関連する気分障害の病態生理に関する詳細な見解が求められています。本ミニレビューでは、うつ病と抗うつ薬の作用に関する分子観点に焦点を当てた気分障害の理解に向けた現在のアプローチの主要テーマを簡潔にまとめます。
はじめに
うつ病や双極性障害のような気分障害は、現代社会において最も一般的な精神障害です。生涯にわたって、一度以上の大うつ病エピソードや双極性障害を経験する人は、それぞれ約16%と1%と推定されています【1】。これらの障害の共通症状は「抑うつ症候群」と総称され、長期にわたる抑うつ気分、罪悪感、不安感、死や自殺への反復思考などが含まれます【2】。うつ病の発現には40~50%の遺伝的要因が関与していると推定されています【3】。しかし、単一の遺伝子の欠陥では多面的なうつ病症状を引き起こすことが難しいため、複数の遺伝的要因の組み合わせがうつ病の発症に関与している可能性があります【4】。また、ストレス、感情的トラウマ、ウイルス感染、神経発達異常などの様々な非遺伝的要因が病気の病因の複雑さを増しています。そのため、広範な研究によりうつ病の分子メカニズムに関するさまざまな仮説が提唱されていますが、明確な病因メカニズムはまだ定義されていません。
約50年間、うつ病研究の中心的なテーマは「モノアミン仮説」であり、これはセロトニン、ドーパミン、ノルエピネフリンなどのモノアミン神経伝達物質の欠乏または不均衡がうつ病の原因であると提唱しています。この仮説は、三環系抗うつ薬やモノアミン酸化酵素阻害薬など、初期の抗うつ薬がモノアミン機能を急性に増強する共通の効果を持つという事実により支持されてきました【5-7】。選択的セロトニン再取り込み阻害薬(SSRIs)の有効な抗うつ薬としての最近の開発は、この仮説をさらに強化しました【6,8】。
しかし、現在の抗うつ薬には解決されていない複雑さが残っています。第一に、抗うつ薬は50%未満の患者にしか効果がなく、最近発見された薬物も適用患者の範囲を拡大することができていません【2】。第二に、臨床効果を得るには抗うつ薬の慢性的な治療が必要であり、その理由は不明です【9】。第三に、うつ病の薬物や気分安定剤は、広範な望ましくない副作用を示します。
特に、モノアミン系を急性に修正する抗うつ薬の臨床効果が著しく遅れるため、現在では慢性治療による遺伝子発現の持続的な変化を含む下流イベントの適応が抗うつ効果の基盤であると考えられています【10】。この現象は、古典的なモノアミン仮説が提唱する生体アミンとうつ病の単純な関係が存在しない可能性を示唆しています。この複雑さは、うつ病がいくつかの基礎病理を持つ障害群であるため、複数の要因によるものと考えられます。また、うつ病の症状の発現には、相互に多層的に機能的に接続された特定の神経伝達物質系の乱れが必要であるかもしれません。総合的に見て、抗うつ薬の効果の開始がモノアミン系の急性変化によって媒介される可能性があることを強調しながらも、現在の研究の焦点は、慢性抗うつ薬治療後の脳内で生じる長期的な下流変化の分子メカニズムに移っているようです。これにより、うつ病や関連する気分障害の病態生理に関する詳細な見解が求められています。本ミニレビューでは、うつ病と関連する気分障害を理解するための現在のアプローチにおける主要なテーマをまとめます。
遺伝子-環境相互作用
うつ病の発症に関連する遺伝子を発見するために、遺伝学者たちは長い間、生活のストレスに対する反応に関与する遺伝子変異を探してきました。生活のストレスは、うつ病の発症において重要な環境要因であり、これは「遺伝子-環境相互作用」の一例です。これは、環境要因が遺伝子の活動を通じてフィルタリングされ、個々のうつ病に対する感受性に差異をもたらす現象です。この目的のために、セロトニン輸送体(5-ヒドロキシトリプタミン輸送体、5-HTT)遺伝子の多型が広範に解析されてきました。5-HTT遺伝子の発現レベルは、5′-フランキング領域(5-HTT遺伝子関連多型領域、5-HTTLPR)および第2イントロンの可変数タンデムリピート(VNTR)の多型によって影響を受けると報告されています【11,12】。特に、5-HTTLPRの短い変異は、長い変異と比較してプロモーターの転写活性を抑制し、5-HTTの発現を減少させ、5-HTの取り込みを減少させることが示されています【13】。さらに重要なことに、遺伝学的研究により、これらの多型がヒトの大うつ病性障害と関連していることが示されています【14】。さらに、ニュージーランドの847人を対象とした縦断研究では、5-HTTLPRの短い対立遺伝子が、失業や離婚などの生活のストレスに対する感受性の増加と関連していることが示されています【15】。この研究では、被験者が重大な生活のストレスにさらされた場合にのみこの多型が影響を及ぼすことが示唆されており、5-HTTが個々の遺伝的構成と環境の引き金となるうつ病との間の接続点である可能性を示しています。これらの観察は、社会的支援のない虐待を受けた子供において、5-HTTLPRの短い対立遺伝子と関連してうつ病のスコアが増加することを示した研究によってさらに強化されました【16】。
しかし、これらの研究からの洞察は、他の研究によって完全には支持されていないようです。5-HTT遺伝子のVNTRの対立遺伝子変異がうつ病に対する感受性と関連していることは、一部の分析では一貫して検出されませんでした【17,18】。メタアナリシスでは、5-HTTLPRと第2イントロンの多型がうつ病患者に見られるが、関連の強さは統計的有意性に達していないことが示されました【19】。1206組の双子を用いた広範な研究でも、5-HTTLPRの主効果や5-HTTLPRの遺伝子型とストレスの多い生活イベントとの相互作用が大うつ病に対して見られないことが示されました【20】。さらに、14の比較可能な研究を使用した最近のメタアナリシスでは、セロトニン輸送体の遺伝子型単独またはストレスの多い生活イベントとの相互作用がうつ病のリスクの増加と関連しているという証拠は見つかりませんでした【21】。これらの研究から得られた混合結果は、遺伝子-環境相互作用を解明するために特定の遺伝子変異に焦点を当てた「候補遺伝子」アプローチの潜在的な弱点を明らかにし、特にうつ病や関連する気分障害のような多因子性の病気に関しては、無偏見な全ゲノムスキャンアプローチの重要性を高めています。
ストレス応答回路
慢性的なストレスはうつ病における重要な要素でありながら、必要不可欠な要因として機能しているわけではありません。この観点から、体内のストレスを管理するための主要な神経内分泌回路である視床下部-下垂体-副腎(HPA)軸は、うつ病研究において注目されています【22】。視床下部の室傍核から分泌される副腎皮質刺激ホルモン放出因子(CRF)は、下垂体からの副腎皮質刺激ホルモン(ACTH)の分泌を促進し【22,23】、その結果、副腎皮質から糖質コルチコイドが分泌され、さまざまな脳領域の神経行動機能に影響を与えます【2】。HPA軸は、海馬や扁桃体などの特定の脳領域を通じてフィードバックループを形成します【24】。高コルチゾール血症、すなわち血中糖質コルチコイドレベルの持続的な上昇は、海馬のCA3錐体ニューロンの興奮毒性を増加させ、その結果、樹状突起の萎縮、スピノジェネシスの減少、ニューロンのアポトーシス、おそらく成人神経新生の抑制を引き起こすと報告されています【25】。慢性的なストレスによって引き起こされる海馬ニューロンのこれらの機能異常は、HPA軸の抑制トーンを低下させ、HPA軸の過活動を引き起こします【23】。注目すべきは、HPA軸の過活動はうつ病患者の約半数に顕著であり、抗うつ薬による慢性的な治療によってこの現象がしばしば逆転することです【23,26】。さらに、動物研究の証拠は、抗うつ薬による慢性的な治療が神経新生を増加させることで海馬の異常な機能の回復に寄与する可能性があることを示唆しています【27,28】。
この点において、HPA軸の機能の弱体化の治療的可能性を評価することが一つの研究方向となります。明白なターゲットは、下垂体に発現するCRF受容体および海馬や他の脳領域に発現する糖質コルチコイド受容体です。これらの受容体は、HPA軸および関連するフィードバックループの核心部分を形成しているためです【24,29-32】。同様の文脈で、バソプレッシン受容体も代替ターゲットとして浮上してきました【33,34】。バソプレッシンはCRF機能を強化し、扁桃体やその他の辺縁系の部分に発現するバソプレッシン受容体を介して働く神経ペプチドです。また、バソプレッシン1b(V1b)受容体の一塩基多型(SNP)は、大うつ病性障害に対する保護効果を持つことが報告されています【35】。興味深いことに、CRF受容体、糖質コルチコイド受容体、バソプレッシン受容体の拮抗は、実験動物において抗うつ効果を示すようです。人間の患者への適用性はさらに精緻化される必要があります。
神経栄養因子
長期的なストレスは、海馬における脳由来神経栄養因子(BDNF)の発現レベルを低下させるようです【36】。また、うつ病患者の死後解剖研究では、BDNFの発現が減少していることが報告されています【37】。さらに、BDNF遺伝子の多型は、神経症性といううつ病に対する感受性の増加に関連しています【38】。家族ベースの関連研究では、BDNF遺伝子の多型が双極性障害と関連していることが示されています【39】。逆に、抗うつ薬の慢性的な治療は、BDNFのレベルを増加させるだけでなく、動物のストレス耐性も向上させます【40,41】。これらの観察結果は、「神経栄養因子説」の基盤となっており、うつ病は神経栄養因子の欠如によって引き起こされ、抗うつ薬はこの欠如を中和するとする説明です。この理論は、前述のストレス応答回路の過活動による海馬地域のニューロン損傷と密接に関連している可能性があります。
BDNFは、さまざまな脳領域でシナプス可塑性を増強することが知られており【42,43】、ストレス誘発性の損傷を受けやすい海馬ニューロンにとってBDNF機能の改善が有益であると推測されます。この考えを支持するため、実験動物の海馬にBDNFを直接注入すると、抗うつ薬治療と類似の行動変化が誘発されることが示されています【41】。したがって、BDNFおよびその受容体TrkBは、新しいタイプの抗うつ療法の有望なターゲットとなっています。
しかしながら、BDNF機能とうつ病の病因または抗うつ薬の効果との間の因果関係は、さらに明確化が必要です。例えば、誘導型BDNFノックアウトマウスを用いた実験では、抗うつ薬の効力が抑制される一方で、うつ病関連の行動は雌性にのみ見られ、有意な性差が示されています【36】。さらに、前頭葉特異的な条件付けTrkB受容体ノックアウトマウスは、強制水泳試験における行動的絶望感の増加などのうつ病関連の行動を示さないことが示されています【44】が、TrkB受容体の活性化が抗うつ薬誘導の行動効果に必要であることが実証されています【45】。したがって、BDNF活性の喪失とうつ病症状の表現との関係は単純な相関ではないことが示されています。それでも、現在の実験結果の複雑さにもかかわらず、新しい抗うつ療法の設計の基盤としての神経栄養因子説の潜在的な価値は排除できません。
ヒストン修飾
抗うつ薬の理解されていない特性の1つは、患者における陽性効果の発現までの長期間の遅延です【10】。この現象は、薬の有益な効果の基盤となる関連するニューロンの適応の遅延開発によるものとされることが多いです。この適応の正体はまだ明確ではありませんが、染色体の状態に持続的な変化が関与していると考えられています。一部のうつ病患者に効果的な慢性電気けいれん療法も、実験動物において広範なヒストン修飾パターンの変化を誘発します【46】。その中で顕著な変化を示すのがBDNFの遺伝子座であり、新しい抗
ヒストン修飾パターンです。BDNFは新しい抗うつ薬の設計の潜在的なターゲットとして考えられていますが、その発現のエピジェネティックな制御は、うつ病の発現と慢性的な抗うつ薬治療の文脈で広範に分析されています。
ラットの海馬では、慢性的な電気けいれん療法がBDNFのプロモーター3および4でアセチル化されたヒストンH3を増加させ、これらの修飾がBDNFおよびCREBの発現増加と相関していることが報告されています【46】。この上昇は動物実験における抗うつ薬の効果と関連しています【28,47】。さらに、慢性的な敗北ストレスといううつ病の実験モデルでは、BDNFの一部のスプライスバリアントの選択的な抑制が誘発され、これはH3-K27ジメチル化、転写の抑制のためのヒストンコードと関連しています【28,48】。逆に、抗うつ薬治療はBDNFの発現の抑制を逆転させる可能性がありますが、これはBDNFプロモーター領域でのH3アセチル化とH3-K4メチル化の誘導によるもので、これらは転写活性化のヒストンコードです【49】。この過程全体で、ヒストン脱アセチル化酵素(HDACs)の役割が重要であり、慢性的な抗うつ薬治療はHDAC5のダウンレギュレーションを引き起こし、その海馬における過剰発現は抗うつ薬の効果を防ぎます【28】。したがって、HDAC阻害剤はうつ病および関連する気分障害の有望な治療法として注目されています。
HDAC阻害剤には、短鎖脂肪酸(例:ナトリウムブチレート(SB)、フェニル酪酸、およびバルプロ酸)、ヒドロキサム酸(例:TSAおよびサブエロイランイリドヒドロキサム酸(SAHA))、エポキシケトン(例:トラポキシン)、およびベンザミドがあります。最も広く使用されている気分安定剤の1つであるバルプロ酸は、HDAC1およびおそらく他のHDACsに対する阻害活性を持っていることから、その気分安定作用は少なくとも部分的にヒストン修飾によると考えられています【50】。また、別の研究では、VPA、SB、およびTSAなどのHDAC阻害剤が脳内でBDNFの発現を増加させることが示されています【51】。したがって、特にヒストン修飾を介したエピジェネティックなメカニズムは、うつ病の発現とその新しい治療法の提案において、新たな機序を提供する潜在的な可能性があります。
成人海馬神経新生
抑うつ患者の脳画像研究は、抑うつ病の病因学の文脈で成人海馬神経新生を探究するための基盤を提供しています [52]。この仮説によれば、慢性ストレスやその他の抑うつ誘発刺激は神経新生を減少させるとされています [53-55]。一方、抗うつ薬の効果は神経新生の増加に依存している可能性があります [54-56]。成人神経新生は海馬の亜脳室帯および亜顆粒細胞帯に限定されており [57]、これは抑うつの発症および治療過程で海馬神経新生の重要性を強調しています。
この考えを支持するために、学習無力感、慢性軽度ストレス、および心理社会的ストレスなど、さまざまな抑うつ動物モデルが海馬神経新生の減少と関連していることが示されています [58-60]。逆に、慢性抗うつ薬治療は神経新生を増加させるだけでなく、新生ニューロンの生存をサポートすることも示されています [61]。
三環系抗うつ薬、イミプラミン、およびSSRIの抗うつ薬効果には、ロッドエントを用いた海馬神経新生が必要です [58,62,63]。さらに、慢性フルオキセチン治療は錐体細胞層のシナプス数を増加させ、歯状回および他の海馬細胞層の棘密度の減少を阻止することが示されています [64]。特に、知能の豊かな環境は海馬神経新生を促進することが知られており [65]、ロッドエントでの抑うつ関連行動の低減に寄与します [66,67]。
抗うつ薬による神経新生増加の分子メカニズムを調べる際には、BDNFの発現レベルが注目されます。さまざまな抑うつ動物モデルでは、BDNFレベルが低下していることが一般的です [40]が、慢性抗うつ薬の投与および電気けいれん療法により、BDNFレベルが増加することが示されています [28,46]。最近の研究では、BDNFを含むCRE含有ターゲット遺伝子の発現を調節する転写因子であるCREBが、慢性抗うつ薬治療で上昇および活性化することが示されています [2,53,68,69]。ただし、CREBの誘導とBDNF、神経新生、および抗うつ薬の行動効果との因果関係はさらに調査が必要です。
最近の研究では、リチウム、バルプロ酸、カルバマゼピンなどの長期抗うつ薬の投与も成人海馬神経新生を増加させることが示されています [70-72]。リチウムは直接グリコーゲン合成酵素キナーゼ-3(GSK-3)およびイノシトール信号伝達を阻害します [73]。VPAはHDACの阻害により遺伝子発現を増強し、間接的にGSK-3活性を阻害し、イノシトール信号伝達を抑制します [71,74-76]。これらの経路が抗うつ薬の臨床効果とどのように関連しているかは明確ではありませんが、データは抑うつおよび関連する気分障害の病因学を構成する共通の分子経路を示唆しています。
薬物離脱後の抑うつ気分
アルコール、精神刺激薬、オピオイド、N-メチル-D-アスパラギン酸(NMDA)受容体拮抗剤などのさまざまな薬物は、人間や実験動物において禁断症状として知られる生理学的な反応を引き起こします [77-80]。薬物離脱によって引き起こされる感情症状の特徴は、重大な抑うつ障害と類似しています [80]。抑うつ気分や無欲症は、薬物離脱と抑うつ症状の両方で一般的に見られます [81]。過食、過眠、疲労感、自殺思考なども、両者で観察される特徴です [82,83]。また、薬物離脱時にはHPA軸の異常も見られ、コルチゾールの増加や脳脊髄液中のCRFの上昇が伴います [84]。また、コカイン離脱初期のコルチゾール、ACTH、β-エンドルフィンの増加は、抑うつ患者と類似しています [85]。陽電子放射断層法(PET)や機能的磁気共鳴画像法(fMRI)を用いた脳画像研究では、メタンフェタミン離脱が前帯状皮質と岩骨のブドウ糖代謝の低下を誘発し、扁桃体と前頭前皮質の代謝活性が増加することが明らかにされています。これらはすべて、臨床的な抑うつに頻繁に見られる特徴です [86]。
多くの証拠が、抑うつや関連する気分障害が脳の報酬回路の中核であるナクレアス(NAc)と腹側被蓋野(VTA)におけるドパミン伝達の異常とともに存在することを示しています [87]。抑うつ患者が快楽表現や動機の獲得に困難を抱えていることはよく知られており、これは通常のNAc-VTAドパミン回路によって主に支配されています [88]。一貫して、ドパミンD2受容体のシグナリングの非調節は実験動物で抑うつ様行動を引き起こし [89]、ドパミンD1受容体シグナリングが変化したニューロン一酸化窒素合成酵素(nNOS)ノックアウトマウスでは抑うつ関連行動が減少することが示されています [90]。ほとんどの薬物乱用物質が直接的または間接的に脳の辺縁系でモノアミン神経伝達を活性化し、報酬感覚を引き起こします [91,92]。したがって、薬物の慢性摂取により報酬効果に対抗する適応が生じ、認知、動機付け、および抑うつ様症状を含む情動的な障害が発生する可能性があると仮定されています [93]。
以上から、薬物離脱後の抑うつ気分は、神経ホルモン変化、脳の地域活動、および薬理学的反応など、臨床的な抑うつと共通の特徴を多く共有しています。ただし、診断的には物質誘発性気分障害と重度の抑うつ障害との間には、発症、経過、持続、物質の関与などの他の要因があることを強調する必要があります [94,95]。一部の実験データは、分子レベルでこれらの状態間の違いを示唆しており、関連する観察を解釈する際には注意が必要です。例えば、両者の場合ともにストリアタムでドパミン輸送体密度が増加していることが報告されています [96]が、コカイン離脱初期には脳幹でセロトニン輸送体密度が増加しています [97]が、臨床的な抑うつではこのような変化は見られません [98]。また、一部の禁断症状の薬物中毒者は抗うつ薬を投与され、薬物の渇望を減少させる効果があるとされていますが、その正の効果はさらなる検証が必要です [99]。しかし、これらの視点から得られる洞察は、脳の報酬回路が抑うつを理解する上で重要である可能性があり、実験動物における抑うつ気分の有用な行動的指標を提供しています。
Circadian rhythms(慨日リズム)
循環リズム(慨日リズム)は、内部時計の制御下での生化学的、生理学的、行動的プロセスの約24時間サイクルです [100-102]。臨床的な観点からは、循環リズムと抑うつや関連する気分障害との潜在的な関連性が古くから仮説されています。たとえば、循環リズムの同調に十分な光周期が不足することが、季節性情動障害の発症の原因となることが比較的よく知られています [103,104]。また、睡眠/覚醒サイクル、体温、血圧、およびさまざまな内分泌機能の異常な調節が、循環時計の制御下で気分障害の主要な症状として顕著です [102,105-110]。ただし、これらの関連の分子機構は依然としてほとんど分かっていません。
最近、分子時計の中心的なコンポーネントであるClock遺伝子の第19エクソンが欠失している変異マウスで興味深い観察がされました。このマウスは、過活動なVTAドパミン作動ニューロンと、双極性障害患者で見られる狂躁症状に類似した行動フェノタイプを示します [111,112]。さらに、双極性抑うつ患者の気分安定剤であるリチウムは、分子時計の中核的な調節成分であるGSK3bを効果的に阻害します。リチウムはまた、Period-Cryptochromeヘテロダイマーの核進入に対する効果を持ち、これは分子時計の負のループを形成するための鍵となるプロセスであり、おそらくGSK3b活性の阻害を介しています。さらに、リチウムはRev-erb aの活性を調節し、生物時計の負のループを正のループに結びつける役割を果たしていると考えられています [113-116]。
循環リズムとモノアミン系との潜在的な関連も報告されています。モノアミン神経伝達物質の合成および/または分泌、およびその受容体の機能は、循環リズムの影響を受けています。ドパミン作動ニューロンにおけるドパミン輸送体およびチロシンヒドロキシラーゼ発現の循環リズムは、視床下部核、すなわち内因性時計の中枢部が損傷された場合にも崩れます [117]。さらに、ClockとBmal1の二量体形成によってモノアミン酸化酵素-A(MAO-A)の発現が調節され、それに応じてMAO-A活性は循環リズムを示します [118]。逆に、脳内のリンビック領域でドパミンD1受容体が活性化されると、Clock、Per1、およびBmal1の発現が促進され、ドパミンD2受容体が活性化されると抑制されます [119]。これらを総合すると、分子時計はモノアミン系と密接に関連しており、循環リズムと抑うつの症状的な相関を分子レベルで説明することができるかもしれません。
日々の気分の変動、内因性分子時計、および抑うつ症状の発現との関係は複雑ですが、抑うつ個体の生物リズムの正常化は有益な効果をもたらす可能性があります。この点で、抗うつ薬としての最近の開発であるアゴメラチンは非常に興味深いです。アゴメラチンはメラトニン受容体の強力なアゴニストであり、内部の循環時計をリセットする能力を持っています [120,121]。さらに興味深いことに、アゴメラチンは5-HT2C受容体に対して拮抗活性を示し、間接的にドパミンおよびノルエピネフリン神経伝達を増強します [122-124]。さらに、アゴメラチンは脳の背側および腹側海馬における神経生成のさまざまな段階に異なる影響を与えることが示されています [125]。アゴメラチンの作用の分子基盤とその効果の理解が進むことで、循環リズムと抑うつの病態生理学のインターフェースに関する興味深い洞察が得られる可能性があります。
Functional anatomy(機能解剖学)
疾患の表現と進行に責任がある脳領域と神経回路の情報は、疾患のより良い診断や、分子、細胞、組織実験から得られた観察を臨床的な文脈で適切に解釈するための重要な基盤です。気分や情動の調節に関与するとされるさまざまな脳領域が知られていますが、気分障害に責任がある中枢神経回路に関する確定的な情報はまだ不完全です。これは、他の多くの神経疾患(例えば、神経変性疾患の一部など)に比べて、患者の解剖学的な病変が一貫して見出されていないためです。
しかし、神経病理学的および神経放射学的研究により、気分障害と脳の構造的異常との興味深い関連が確立されています。例えば、気分障害患者の死後神経病理学的研究では、前帯状回のグリア減少や側頭前頭前皮質の神経細胞の異常が観察されました [126,127]。MRIを用いた放射学的研究も、前頭葉軌道部および副腹側前帯状皮質の容積の減少を明らかにしました [128-130]。これらの領域への電気刺激は抗うつ効果を引き起こす相関関係が示されています [131]。特に、高齢のうつ病患者においては海馬の容積の減少が報告されています [132,133]。
最近のfMRIを主に用いた脳画像研究は、抑うつ症状に重要な役割を果たす脳領域に関する情報を追加しています [134]。前頭腹側皮質、帯状回、海馬、基底核、扁桃体、視床などの脳領域の機能的な変化が、抑うつと相関しています [52]。新皮質と海馬も、うつ病患者で一般的な認知機能の欠損に関連した症状において重要な役割を果たしているようです [55]。また、ナクレアス・アクンベンスと扁桃体は、無欲や情動記憶関連の症状の中核領域と見なされています [135,136]。視床の機能的な変化も、睡眠および食欲に関連する症状と関連しています [137]。これらのトピックに関する研究は、脳画像技術の急速な進展によって現在加速されており、従来の解剖学的研究からの情報と組み合わせて、うつ病に関連する神経回路のより高解像度な画像を形成する要因となっています。
むすび
抑うつ症や関連する気分障害を効果的に制御するためには、その詳細な分子経路を理解することが不可欠です。抑うつの古典的ストレスモデルと現在の抗うつ薬の作用理解が、エピジェネティックメカニズムや海馬神経新生を介して部分的に結びついていることが示されています(図1)。しかし明らかなことは、現在の抑うつの病態生理学の画像は大部分が不完全であり、それゆえに多くの潜在的な仮説が生成され、試験されており、断片化した神経生物学的な抑うつや関連気分障害の視点を形成しています。
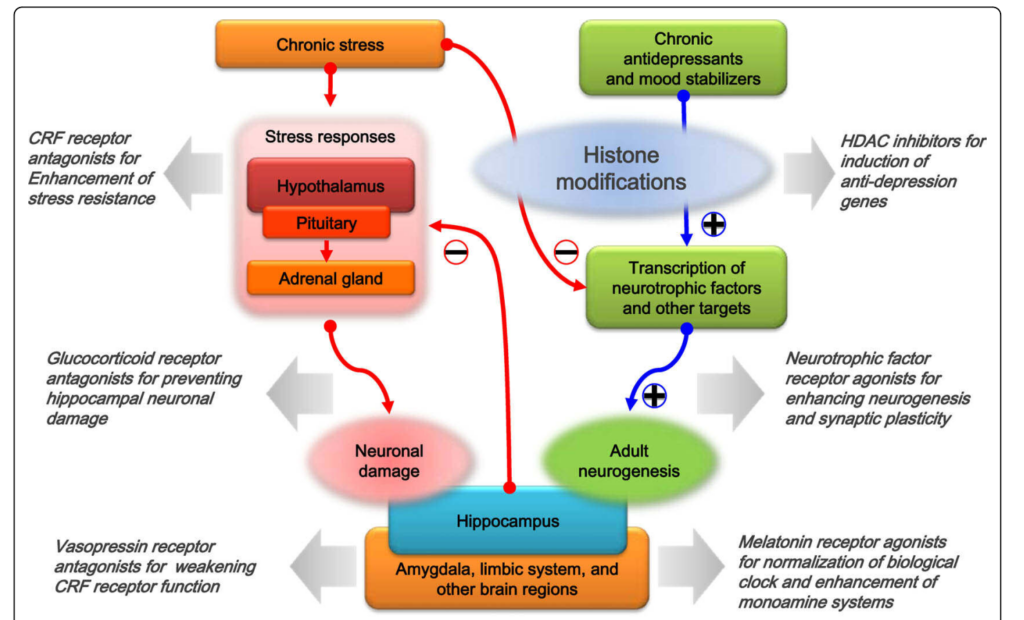
Here is the translation of Figure 1:
図1 抗うつ薬の開発アプローチ:非モノアミン性成分を標的とする場合。慢性ストレスは過剰コルチゾール血症を引き起こし、これにより海馬での神経細胞の損傷が起こり、HPA軸のフィードバック抑制が弱まる可能性があります。また、慢性ストレスはエピジェネティックメカニズムを介して神経栄養因子の発現を抑制することもできます。一方、抗うつ薬や気分安定剤の慢性治療は、抗うつ遺伝子の発現を促進するエピゲノム環境を確立することができます。これらのターゲットには、神経栄養因子の遺伝子が含まれ、神経細胞の損傷を防ぎ、海馬神経新生を促進する可能性があります。非モノアミン性成分を標的とする抗うつ薬の開発アプローチの一部も示されています。
この分野での主要な課題の一つは、関連する仮説を統合し、抑うつや関連障害の病態生理学の全体像を形成することです。そのための重要なステップとして、抑うつの高解像度の神経回路を定義することが挙げられます。これにより、分子、細胞、組織実験から得られた観察をより良く解釈するプラットフォームが提供されます。もう一つの重要なステップは、抑うつを引き起こす「抑うつ遺伝子」を特定することです。これにより、遺伝子動物モデルを生成し、実験動物を用いた抑うつ研究における多くの問題の明確化に役立ちます。また、候補抗うつ薬の潜在的な効力を評価するのにも有用でしょう。
最後に、この分野で最も困難な課題は、現在の治療法の限界を克服することです。現在の治療法は一部の患者にしか効果がないという問題です。非モノアミン系を標的とする新しい抗うつ薬が、治療可能な患者の範囲を拡大することが期待されて久しいですが(図1)、その進展は期待を下回っており、この課題は依然として切実なものとなっています。
3つめの論文【ドイツでの卒後教育の材料】
CONTINUING MEDICAL EDUCATION Treatment of Depressive Disorders Tom Bschor, Mazda Adli
要約:
- 導入: うつ病治療にはさまざまな選択肢があり、それが臨床家や患者の間で混乱を引き起こす可能性があります。
- 方法: このレビューは、現行のガイドラインを考慮した選択的な文献レビューの方法を使用しました。
- 結果: うつ病の治療には急性期、維持期、予防期があります。主な治療法には薬物療法、心理療法、支持的戦略が含まれます。現在市場に出ている約30種の抗うつ薬は、主に副作用プロファイルが異なります。ドイツでは、公的医療保険で賄われる心理療法の種類には、認知行動療法、精神動態療法、精神分析があります。睡眠剥奪を除くすべての治療法は、数週間の遅延を伴い、30%から50%の非反応率があります。臨床実践では、段階的なアプローチが重視され、潜伏期後の反応の標準化評価を行い、非反応の場合は次の治療ステップを開始することが推奨されています。
- 議論: うつ病の治療は、効果的に利用すれば一般に良好な予後を示します。重要な要因としては、適切な期間(抗うつ薬で約4〜6週間、心理療法で約4〜12週間)の治療を継続し、その後に反応を標準化して評価することが含まれます。
- 出典: このレビューは2008年に Deutsches Ärzteblatt International 誌に掲載されました(第105巻、第45号、782-92ページ)、DOI: 10.3238/arztebl.2008.0782。
- キーワード: うつ病、抗うつ薬、段階的抗うつ薬治療、治療アルゴリズム、心理療法
この要約は、現在の理解とガイドラインに基づくうつ病の管理のための構造化されたアプローチを強調し、体系的な評価と段階的治療戦略の重要性を示しています。
甚だしいうつ病の診断評価と、それらを軽度、中等度、重度に分類する方法は、以前に Deutsches Ärzteblatt 誌の早期号で述べられました (1)。うつ病が正しく診断された場合、現在多くの効果的な治療オプションが利用可能です。うつ病の予後は、適切かつ一貫した治療が行われる場合に良好です。
この記事の学習目標は以下の通りです:
- うつ病の治療の基本を理解する(適応、設定、治療段階、治療ステップ)
- 医患関係の確立の原則を学ぶ
- 抗うつ薬の薬物療法に関する基本的な知識を得る
- 異なる形式の心理療法でのうつ病治療についての知識を得る
この継続医学教育記事は、文献の選択的レビューに基づき、著者自身が外来および入院治療でのうつ病患者の豊富な経験を組み合わせています。一般開業医や家庭医によって提供可能な治療に重点を置き、現在のうつ病治療の状況を紹介しています。
適切な悲しみとは異なり、治療が必要なうつ病エピソードの証拠には以下が含まれます:
- うつ病症候群の持続期間が2週間以上
- 積極的な経験でも軽減されない持続的なうつ状態
- 感情の欠如感(患者自身が悲しいとは感じず、「石になった」とか「内部が死んでいる」と感じる)
- 典型的な昼夜の変動、朝の低下と夕方の改善
- 有機的原因がない身体症状
- 不適切な罪悪感、またはうつ病的妄想
- 自殺の傾向
- 重度のうつ病の過去のエピソード
- 家族歴に重度のうつ病性障害があること
【治療設定】
うつ病は非常に一般的な状態です (1)。したがって、少なくとも合併症のない症例においては、その診断と治療は精神科医だけでなく、一般開業医や家庭医の任務でもあります。
❃ 精神科医への紹介の適応は以下の通りです:
- 診断の不確実性
- 精神疾患との合併症(例:中毒、認知症、人格障害)
- 重度のうつ病症状
- 妄想性うつ病
- 双極性感情障害の設定でのうつ病(双極性うつ病)
- 自殺の傾向
- 慢性化したうつ病
- 不適切な反応、つまり適切に行われた1〜2回の治療に対する反応が得られない場合
- 精神療法の必要性、または家庭医療の設定では提供できない治療の強度の必要性
❃ 精神科入院治療の適応は以下の通りです:
- 急性の自殺の傾向や他の自己危険行為(例:食事の拒否)
- 重度の妄想性または他の精神症状
- うつ状態
- 疾患またはその他の理由により、定期的な外来治療に参加できない状態(例:ドライブの欠如)
- 十分な支援的社会ネットワークの欠如による自己の放置の危険性
- 外来治療の成功を妨げる外部生活条件、例えば重度の家族間の対立
- 外来治療への反応の欠如
【治療の段階と目標】
うつ病の治療は3つの段階に分かれています (2, 3)。急性期療法の目標は、うつ病の症状の完全またはほぼ完全な寛解です。うつ病の治療反応の速度は異なるため、急性期療法は数週間から数ヶ月にわたって行われる場合があります。
急性期の後、維持療法が行われ、早期の再発を防ぐことが主な目標です。維持療法の期間は6から12ヶ月間に及びます。維持療法は、急性期に寛解を誘導した治療形態に関係なく、再発のリスクが高いためこの期間中に推奨されます (4)。一般的に、寛解をもたらした治療形態は維持期に変更せずに継続されます。維持療法のさらなる目標は、完全な機能的回復、つまり患者が自宅や職場などで疾患発症前の機能レベルに完全に戻ることです。
予防療法は、その病気が再発することが多い患者にのみ推奨され、個々の場合に再発の可能性に応じて判断されます。再発のリスクは、過去のうつ病エピソードの数やそれらの間隔から最もよく判断されます。予防療法が適していると考えられる場合、時間的な終点を考慮せずに開始されるべきです (4)。このレビュー記事では主に急性期療法に焦点を当てます。
【治療の原則】
うつ病の主な治療方法は次の3つです:
❃ 薬物療法
❃ 精神療法
❃ 支持的対策
特に軽度のうつ病の場合、自然寛解率がかなり高いため(未治療のエピソードは平均で6〜8ヶ月続く)、医師と患者は治療を開始する前に2〜4週間の「待機期間」に合意することがあります (5)。
軽度または中等度のうつ病の初期治療は、患者の希望や治療法の利用可能性に応じて、単一の薬物療法または精神療法のいずれかで行われるべきです。重度、再発性、または慢性化したうつ病、および高齢者のうつ病患者では、これら2つの治療モダリティの組み合わせが有益である場合があります。
【基本的な治療戦略】
うつ病の治療の基盤は、特定の形態の精神療法に限定されることなく、共感的で理解のある医師との会話にあります。安定した治療的同盟の枠組みの中で、患者は自身の悩みや恐れを医師が受け入れていると感じ、治療面接によって特に罪悪感や無力感に対して安心感を得るべきです。医師は、うつ病が治療可能であり、良好な予後を持つことを患者に確信させることで楽観を促します。このためには、特に急性期において、生物学的モデルを用いて患者に自身の症状を理解させることがしばしば役立ちます。これにより、うつ病の症状が病気の表現として一時的な日常生活の責任からの解放であることが認識され、しばしば不可解で脅威とされていたうつ病の特性も解消されることがあります。
一方で、慢性的にうつ病のある患者には、段階的な活性化と個別の責任とイニシアチブの促進が必要です。過度に負担された家族はしばしば非生産的な批判や軽視(「すべて大丈夫になるよ、それほどひどくない」という言葉)または「気を引き締めてください」という助言で反応しますが、これらはすべて役に立たず、むしろ患者の家族にもうつ病を治療可能な病気として教育し、回復を促す取り組みに協力してもらう必要があることを強調します。患者やその家族は、セルフヘルプグループや家族グループに参加することにも動機付けられるでしょう(この記事の末尾にリストされているドイツのインターネットアドレスを参照)。
うつ病の特別な危険性は自殺の可能性です。うつ病を患う人の3%から15%が自殺し、自殺者の40%から70%がうつ病を患っていました(e1)。
治療の過程で自殺の問題は常に再三取り上げられるべきです。この話題が議論されるとほとんどの患者は安心する傾向があります。具体的な管理については、Rudolfらによる記事を参照してください(1)。ほとんどの自殺は何らかの形で事前に通告されていますが、これは直接的または間接的な方法で行われます。
自殺のリスクが高い患者に対する重要な対策は以下の通りです:
❃ 精神療法的な危機介入の直ちの開始。安定した医師と患者の関係は最も効果的な保護因子です。したがって、家庭医はこのような状況で中心的な役割を果たします。
❃ 専門の精神科医への紹介
❃ 近接した間隔での短期フォローアップと、次のセッションの時間と場所について明確で曖昧のない合意—「調子が悪い場合は連絡してください」というような曖昧な提案ではなく
❃ 具体的で24時間体制の助けの提供:精神科危機対応サービスまたは救援センターの電話番号
❃ 患者に自殺の考えを延期することに同意してもらい、特定の期間内に自分を傷つけないという反自殺の契約を結ばせること。後者は患者と医師の間で行われ、患者が特定の期間内に自分を傷つけないと約束するものです。
❃ 必要に応じて、関連する法律に従って入院の紹介または強制入院
❃ 急性自殺性の場合、ベンゾジアゼピンの使用が適切な場合は投与します。
すべての患者が反応する単一の治療方法はないため、通常、うつ病は段階的な治療ステップで治療されます (7)。各ステップの期間は、使用される方法が効果的になるチャンスを与えるには長すぎず、治療を不適切に長引かせることを避けるためにも短すぎません。抗うつ薬の治療には一般的に4週間(高齢者の場合は6週間)、特定の形態の精神療法には4〜12週間が適切とされています。
この期間の終了時には、患者の治療への反応が標準化された方法で評価されるべきです。このためには、治療ステップ開始時の患者の疾患表現の詳細な文書化が不可欠です。確立された、使いやすいうつ病重症度尺度も役立ちます—外部評価尺度(例:ハミルトンうつ病評価尺度 [8])と自己評価尺度(例:ベックうつ病尺度 [9])。これらの尺度における「反応」とは、対象の治療ステップ中に全体スコアが少なくとも半分になることを意味します (10)。これが達成された場合、治療の次のステップに向けて完全な病気の寛解を目指すべきです。一方で、非反応の場合は次の治療ステップに移行するべきです。
薬物療法
抗うつ薬
抗うつ薬はうつ病の薬物療法において中心的な役割を果たします。ドイツでは約30種のこのクラスの物質が承認されています。これらは全てほぼ同等に効果があります (5)。その反応不良率は1/3から1/2に及びます。全ての抗うつ薬は、その治療効果が始まるまでの時間がほぼ同じであり、実臨床においては2〜4週間の遅効性が想定されます(EBMレベルA [Ia])。
ごくわずかの例外を除き、すべての利用可能な抗うつ薬は主に中枢神経系でセロトニンおよび/またはノルアドレナリンのシナプス濃度を上昇させることによって作用します。彼らがこれを行う具体的なメカニズムには異なりがあります (11)(表1参照)。
植物療法(セイヨウハッカ)
セイヨウハッカの製剤を用いた植物療法は特にドイツで非常に人気があります。この薬剤の効果に関する科学的証拠は現在混合されており、多くの研究が重大な方法論上の欠陥を抱えています。現在のメタ分析(5)によれば、セイヨウハッカは軽度および中等度のうつ病の治療においておそらく効果があると結論されています。現在、ドイツ市場で利用可能な40種以上のセイヨウハッカ製剤には、400種類以上の個々の化学物質の濃度が非常に変動します(5)。
広く知られていないが、臨床的に高度に関連する事実として、セイヨウハッカは他の薬剤との相互作用の重大なリスクを伴います。シトクロムP450系のアイソ酵素を誘導することで、経口避妊薬、抗凝固薬、ディゴキシン、テオフィリン、他の抗うつ薬、サイクロスポリン、抗HIV薬を含む多くの薬剤の効果を弱める可能性があります。同様に、患者がセイヨウハッカの服用を中止すると、これらの薬剤の血清濃度が上昇します。
ベンゾジアゼピン
ベンゾジアゼピンは厳密に言えば抗うつ効果はありませんが、急性鎮静作用および抗不安作用があり、その使用は重度のうつ病および自殺的な患者に14日間以上ではない期間にわたって適応される場合があります。このような治療は、すでに述べたように抗うつ薬の効果が遅いためしばしば必要とされます。ただし、ベンゾジアゼピンのリスクと禁忌も考慮する必要があります。例えば、依存歴はベンゾジアゼピンの使用を禁忌とするリスクがあります。
抗精神病薬
古いものも新しいものも含めて、神経症性うつ病の単独治療に対して効果が示されていない抗精神病薬があります。抗精神病薬は幻覚性うつ病の治療のみに適応され、精神科医によってのみ処方されるべきです。いくつかの非定型抗精神病薬は、抗うつ薬に追加投与することで効果があるとされています(増強療法)。ただし、抗精神病薬はこの適応には承認されていません。
フルスピリレンの週次注射は、遅発性ジスキネジアのリスクがあるため与えてはいけません。
リチウム
いわゆるリチウム増強療法は、抗うつ薬に反応しないうつ病の急性治療において役割を果たします(12)。また、リチウム単独療法は再発性うつ病の予防的な治療に有効です。リチウム治療には特別な知識と予防措置が必要であり、経験豊富な医師によってのみ処方されるべきです。
薬物療法の進行
患者教育と共同意思決定
治療の効果、期間、および副作用についての徹底した患者教育は、薬物療法の重要な要素です。患者には、急性期治療後にメンテナンス療法が必要であることも説明されます。これらの問題を患者と話し合う際、医師は依存症や人格の変化などの広く誤解された不安や根拠のない恐れに対処しなければなりません。精神科薬物の服従はしばしば不十分ですが、抗うつ薬の効果の遅延を患者に知らせ、可能な副作用を事前に説明することで改善することができます。共同意思決定(13)とは、十分に情報を得た患者が医師と共に提案された抗うつ薬の服用について決定することができるということです。患者の家族もこのプロセスに参加させることで服従を改善することができます。
抗うつ薬の選択
急性期治療のための抗うつ薬の選択は、副作用プロファイルに基づいて主に行われます。急性期治療に使用される薬剤はすべて同程度に効果的です(表2)。特定の抗うつ薬が以前のエピソードの治療で効果的であれば、その薬剤が選択されるべきです。
鎮静作用は、患者が睡眠障害を抱えている場合には不要であるか有益であるかによって、望ましくない副作用です。三環系抗うつ薬はいくつかの状況で避けるべきです(5):
❃ 前立腺肥大症、緑内障、認知機能障害/認知症、便秘、および他の抗コリン作用薬との併用において、抗コリン作用の副作用があるため。
❃ 既往の心臓病患者においては、心臓伝導異常や不整脈を引き起こす可能性があるため。
❃ 自殺的または認知障害のある患者においては(故意または事故による過剰服用のリスクがあるため)、他の抗うつ薬と比較して過剰摂取時の毒性が高いため。
メンテナンス期には、急性期で寛解に導いた同じ抗うつ薬を投与することが合理的で確立された実践です(4)。ただし、ドイツではメンテナンス薬として公式に承認されているのはベンラファキシンだけです。再発性うつ病の予防療法には、抗うつ薬または代わりにリチウムを使用することができます。
投与量
各抗うつ薬には最小有効量があります。これらの標準的な投与量は表2にリストされており、初期にはゆっくりと増量しながら与えられる準備の異なる開始投与量も含まれています。高齢患者については、他の患者とは異なり、標準量よりも低い投与量でも効果があり、実際には合併症が少ないため適している場合があります。維持療法の段階でも、急性期に寛解を引き起こした抗うつ薬の同じ投与量が処方されるべきです(4)。現在、予防的な治療のための具体的な投与量を推奨するのは非常に難しいので、現在利用可能なデータが限られています。
モニタリング
急性期療法の最初の4週間では、患者は少なくとも週に1回のフォローアップで受診すべきです。各フォローアップで、患者の薬剤耐容性を評価し、患者の懸念事項に対処する必要があります。治療の4週間後に反応を評価すべきです。
以下のテストがフォローアップで推奨されています:
❃ 抗うつ薬の治療前に、完全血液検査とトランスアミナーゼ
❃ 三環系抗うつ薬(TCA)を使用する場合、ECGも行う
❃ TCAまたは選択的セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)を使用する場合、血圧測定
❃ 治療の過程で、定期的に完全血液検査とトランスアミナーゼ、または(上記の状況で)ECGと血圧測定、特に投与量が増える場合
❃ 選択的セロトニン再取り込み阻害剤(SSRI)を使用する場合、特に高齢患者では低ナトリウム血症のリスクがあるため、治療の過程で血清電解質を測定する必要があります。
反応が得られない場合の対応
十分な期間、適切な投与量で抗うつ薬治療に反応しない場合、治療戦略を変更する必要があります。この状況では、いくつかの選択肢があります。
まず最初に検討すべき合理的な手段は、使用中の抗うつ薬の血清濃度を測定することです。これは治療薬物モニタリング(TDM)と呼ばれ、患者の服従をチェックするだけでなく、個々の患者で標準投与量を使用した際に血清濃度が不十分になる可能性のある代謝的特異性を検出する手段です。薬剤を服用する前に血液を採取する必要があります。しかし、多くの新しい抗うつ薬については、治療的血清濃度と臨床的反応との間に確立された信頼できる関連性がまだないため、TDMは主に三環系抗うつ薬やベンラファキシンを使用している場合に推奨されます。
治療開始後の初期の抗うつ薬治療に反応しなかった場合、一般的な戦略は別の抗うつ薬に切り替えることです。通常、別の抗うつ薬クラスからの薬剤を選択することが推奨されます。しかし、この戦略の効果に科学的根拠はありません(14)。したがって、急性期において抗うつ薬を2度変更するべきではなく、2番目の抗うつ薬も反応をもたらさない場合、他の戦略を使用する必要があります。
高用量の抗うつ薬治療(表2参照)は多くの抗うつ薬にとって合理的な選択肢です(15)。SSRIは例外であり、これらの薬剤には明確な投与量-反応関係がないため、SSRIの投与量増加には理論的根拠がありません(15)。高用量で与えられる抗うつ薬は、より重篤な副作用を引き起こす可能性があります。三環系抗うつ薬を高用量で投与する場合、ECG検査はより頻繁に行う必要があります。ベンラファキシンの場合は、血圧も頻繁にチェックする必要があります。高用量療法への反応は、治療効果が現れるまでの知られた潜伏期のため、開始後約4週間を早くとも評価すべきです。
抗うつ薬単独療法に対する反応不十分後のさらなる合理的な治療戦略は、2種類の抗うつ薬の併用療法です。しかし、併用療法の効果は、特定のタイプの組み合わせについてのみ文書化されています。具体的には、再取り込み阻害剤(三環系抗うつ薬またはSSRI)と前シナプス自己受容体ブロッカー(ミルタザピン、ミアンセリン、トラゾドン)の組み合わせです(16)。
リチウム増強療法は、これまでの単独療法で効果がなかった抗うつ薬にリチウムを追加する治療です。リチウムの追加により、多くの患者で反応が引き起こされる可能性があり、数多くの研究とメタアナリシスで示されています(12)。
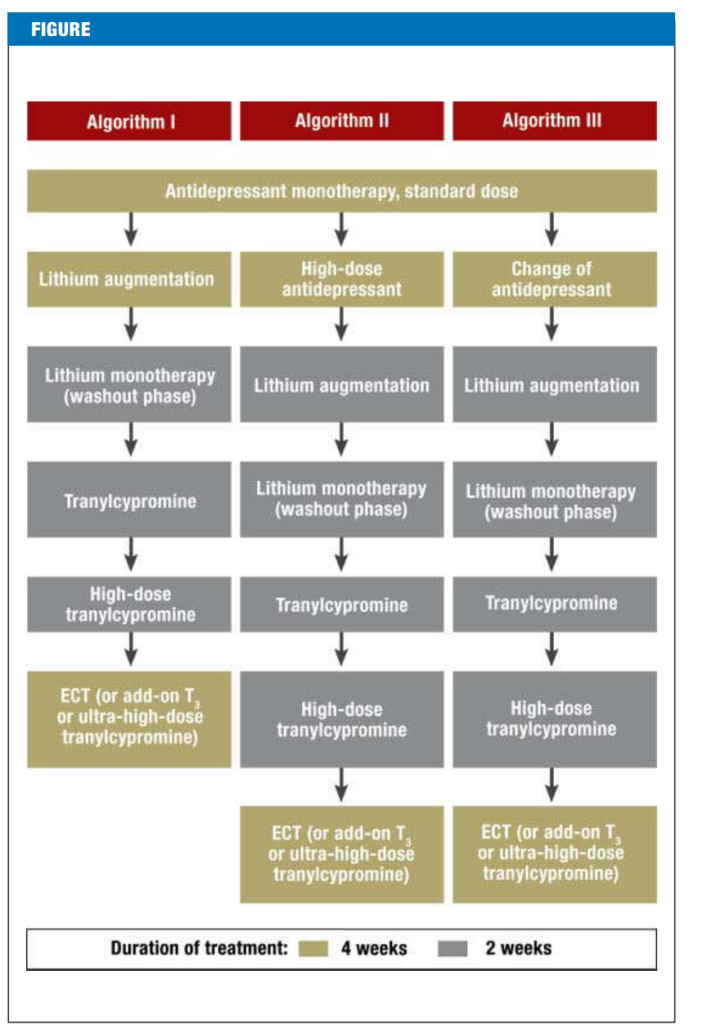
I’m sorry for any confusion earlier. Here’s the translation:
抑うつ症の段階的治療のためのアルゴリズムベースのフローチャート。このフローチャートは、ドイツ抑うつネットワークのアルゴリズム研究の三つのアームを示しています。この研究はドイツ連邦教育研究省の支援を受けており、関連する文献からは明確な推奨がなされていません。患者がどのアルゴリズムの次の段階に進むかは、意思決定プロセスの機能です。各段階の最後には、ハミルトン抑うつ評価尺度(HAM-D、21項目版)によって抑うつの重症度が評価されます。
T3、トリヨードチロニン
• HAM-D ✜ 9:寛解 ➞ 2週間後に再評価して寛解を確認、確認された場合は維持療法へ移行、確認されない場合は次の段階へ
• HAM-Dが少なくとも8点減少(総合スコアが9以上):部分的な応答 ➞ 現在の段階を2週間延長(段階ごとに1回まで)
• HAM-Dが8点未満減少:非応答 ➞ 次の段階へ
精神療法
さまざまな形態の精神療法がうつ病に対して効果的であることがよく文献に記録されています。治療効果の大部分は、特に精神療法的な設定外でも機能する一般的で非特異的な要因によるものと考えられています。これらの要因の中で最も重要なのは、受容的で積極的に聴くことができ、共感的な医師との体系的に確立された治療的な関係です。医師自身が「治療薬」となり、その重要性は過小評価できないほどです。
うつ病の精神療法的アプローチのほとんどは、以下の戦略を含んでいます:
❃ 資源の活性化(患者の現在の能力の特定と強化)
❃ 問題の実体化(特定の葛藤領域への直接的な対処)
❃ 問題の対処(感情的、認知的、または積極的な解決策で患者を支援する)
❃ 動機づけの明確化(問題のある知覚と行動のモード、および機能不全の認知の認識)
薬物療法と同様に、患者は定期的に再評価され、副作用の可能性が現れるかどうかが評価されるべきです。また、適切な治療期間後に治療効果も評価されます。
特定の精神療法的技法
うつ病の精神療法は、外来または入院設定で個別にまたはグループで行うことができ、患者の家族の参加の有無で行うこともできます。ドイツでは、法定健康保険者は現在、通院行動療法と深層心理学に基づく解析精神療法を「ガイドライン技法」として払い戻します。
認知行動療法
認知行動療法(CBT)は、機能不全の認知が感情と行動の障害を引き起こすという仮定に基づいています。うつ状態におけるポジティブな強化の欠如が患者のうつ病症状を悪化させます。CBTは認知と行動の両面でアプローチし、患者のポジティブな強化の欠如、社会的な引きこもり、自己の無力感に対処します。うつ病の患者の間でしばしば特定される「認知エラー」には、適切でない一般化、個人化、感情的思考、白黒思考が含まれます。うつを引き起こすとされる「うつ生成」の認知スキーマも、生涯初期に学習され、重要な生活イベントで再活性化される可能性があります。認知療法は、これらの機能不全な認知を修正することを目指して、平均20回のセッションで構造化された指導短期療法で行われます。
通院CBTのうつ病に対する有効性は非常によく研究され、メタアナリシスでも確認されています(17、e2-e4)。
深層心理学と精神分析的精神療法
古典的な精神分析的治療は、患者が長期間にわたって週数回、横になって行うものです。深層心理学に基づく精神療法は、精神分析の中心的な基本的仮定と原則に基づいていますが、通常は患者が椅子に座って週に1回だけ行われ、短期間です。これらの精神療法の両方は、うつ病障害が主に無意識の過程に起因するものであり、その根源は通常、患者の幼少期にありますという仮定に基づいています。特にうつ状態の人々は、その関係における不確実さや、損失と侮辱に対する増加した脆弱性を伴う否定的な結合様式で苦しんでいます。他の種類の精神療法よりも、治療者と患者の関係自体が治療の対象となります。なぜなら、患者の典型的な関係パターンと不安がこの関係内で再現され、それを内面化することができるからです。
効果の証明されたコントロールされた研究データは、CBTほどは広範囲ではありません。軽度または中等度のうつ病患者におけるより構造化された短期深層心理学的精神療法が最も頻繁に研究されてきたタイプです(e5)。他の研究やメタアナリシスは、さまざまな診断の混合した患者を対象としているため、これらの治療方法のうつ病に対する効果について具体的な結論を導くことは難しいです(e6、18)。
対人心理療法(IPT)
IPTは、うつ病の治療を目的として特に開発された短期の精神療法の一種です。セミ構造化された精神療法が週に1回行われ、通常12から20時間のセッションで構成されています。IPTはうつ病の心理社会的および対人関係の側面に焦点を当てており、特に悲しみの対処、役割の切り替え、生活の変化、対人関係の葛藤に重点を置いています。
制御された研究やメタアナリシスから、IPTの効果が多くの証拠と共に示されています(19)。IPTは単独で使用される場合や抗うつ薬と併用される場合がありますが、現在ドイツの法定健康保険者によっては払い戻しがされていません。
支援措置
患者の家族を巻き込むことの重要性は何度か述べられています。うつ病の唯一の即時の治療効果を持つ治療法は、睡眠剥奪です。これは入院または通院で行うことができます。患者は一晩中眠らずに過ごす(完全な睡眠剥奪)か、または午前1時から2時の間に起きて活動する(部分的な睡眠剥奪)必要があります。眠気が来ても短時間の昼寝をしてはいけません。この治療の成功のためには、患者が覚醒期においても少しでも眠らないことが重要です。この治療を受けた患者の約60%が、翌日には気分が大幅に改善するとされています。
睡眠剥奪治療の主な欠点は、その効果が患者の約80%で1日または2日しか持続しないことです。治療が効果的であれば、3日から4日ごとに1回繰り返すことができます。絶対的な禁忌症はてんかん発作の既往歴がありますが、相対的な禁忌症には双極性や精神病性うつ病が含まれます。
特殊な装置を用いた光療法の効果は、季節性うつ病(冬季うつ病)に対してのみ明確に証明されています(e7)。身体活動はうつ病の解消に有益な効果があると考えられており、これを補完的治療として推奨することができますが、その科学的データはまだ不十分です(e8)。現在調査中の治療法には有酸素トレーニングや持久力トレーニング(ランニングマシンでの運動)が含まれます(20)。
うつ病のすべての治療法の中で、おそらく最も効果的なのは電気けいれん療法(ECT)です。現在の主な適応は治療抵抗性うつ病です(21, 22)。この治療形態には専門的な人員と機器が必要であり、また広範な不安から使用される頻度は低いです。これは、複数の前治療が失敗した場合や患者が明示的に要求した場合にのみ使用されます。その有益な効果は通常、週に3回のECTセッションで治療を開始してから1〜3週間後に現れます。早期再発率は初めの16週間で最大75%に達することがあります。適切な維持療法により、早期再発率を約35%まで減少させることができますが、これらの再発は完全に防ぐことはできません。
むすび
現在、うつ病は効果的に治療可能です。治療方法は相互に補完しあったり、併用することができる複数存在し、適切に設計された制御された研究でその効果が十分に文書化されています。どの治療方法も全ての面で優れているわけではなく、比較的高い非反応率が共通の特徴です。したがって、うつ病の治療の芸術は、利用可能な治療オプションを方法論的かつ徹底的に使用することにあります。アルゴリズムに基づく段階的治療計画(図)の枠組みの中で、各治療段階が適切な期間行われ、その後、標準化された方法で効果が評価されます。ランダム化比較研究によれば、段階的治療は非構造化治療よりも頻繁で迅速な治療反応をもたらし、同時に処方する精神活性薬の量や治療戦略の変更頻度を減少させることが示されています(7)。
質問1
抑うつ症の維持療法の目的は何ですか?
(a) 相互予防
(b) 寛解
(c) 反応
(d) 症状の軽減
(e) 早期再発の予防
質問2
現在ドイツで利用可能な約30種類の抗うつ薬は、他と最も異なる点は何ですか?
(a) 副作用プロファイル
(b) 非反応率
(c) 中毒性の可能性
(d) 発現の遅延
(e) 効力
質問3
あなたが中等度の重度の抑うつ症を診断した68歳の女性が、唯一の薬理療法としてセントジョーンズワートを受け入れる場合、この物質を含む製剤を処方する場合の特別な注意点は何ですか?
(a) 病的肥満の可能性
(b) 心電図
(c) 同時に服用している薬剤
(d) 腎機能
(e) 可能性のある中毒
質問4
2か月前に始まった抑うつの歴史を持つ59歳のバス運転手があなたのもとに訪れました。あなたは三環系抗うつ薬で治療を考えています。次のうち、このタイプの薬剤を処方しないことになる共病症はどれですか?
(a) 気管支喘息
(b) 痛風
(c) 前立腺肥大
(d) 乾癬
(e) リウマチ性関節炎
質問5
抑うつ症に対する最も迅速な作用の治療は何ですか?
(a) 抑うつ専門の精神療法
(b) 電気けいれん療法(ECT)
(c) 光療法
(d) 抗うつ薬の薬理療法
(e) 睡眠剥奪
質問6
深層心理学に基づく精神療法の理論によれば、抑うつ症の人々でより一般的な心理現象は何ですか?
(a) 境界性人格構造
(b) 親の潜在的な同性愛
(c) ペニスエンヴィー
(d) 損失に対する増加した脆弱性
(e) 平均を上回る知能
質問7
次のうち、多数のコントロールされた研究とメタ分析によって効果が十分に証明されている抗うつ治療はどれですか?
(a) 身体活動
(b) 精神病性モノセラピー
(c) 高用量SSRI治療
(d) 外来の認知行動療法
(e) 非反応時の抗うつ薬の変更
質問8
抑うつ症のアルゴリズムに基づく段階的治療計画とは何ですか?
(a) 対症療法と薬理療法の間の交互
(b) 患者の抑うつを軽度、中等度、重度に分類し、系統的評価に基づいて治療を選択する
(c) 単剤療法または抵抗性治療の程度に応じて2つ、3つ、または4つの治療方法の組み合わせで治療
(d) 個々の患者のデータを処理する治療ソフトウェアを用いて、応答確率行列に基づいて治療計画を決定する
(e) 治療の開始時に段階的治療計画を決定し、各段階の終了時に標準化された反応評価を行い、その結果が次の治療段階への移行を決定する
質問9
認知行動療法の基本的な仮定は何ですか?
(a) 抑うつの病因において感情よりも認知に圧倒的な重点を置くことが中心的な要素である。
(b) 抑うつ障害は主に無意識の過程に基づいている。
(c) 機能不全の認知が感情と行動の障害を引き起こす。
(d) 抑うつ障害の中心には認知的自我分裂がある。
(e) 過度なポジティブな強化が消費社会における抑うつの主要な原因である。
質問10
抑うつ治療の開始前および治療経過中定期的に推奨されるテストは何ですか?
(a) セルトラリン治療のストレス心電図
(b) ベンラファキシン治療の血圧測定
(c) シタロプラム治療の脳波
(d) アミトリプチリン治療の代謝者ステータスの確認
(e) レボキセチン治療の血清レベル測定
典型的な症例紹介
46歳のオフィスワーカーが妻に付き添われて家庭医の診察を受けました。彼は持続的な頭痛を訴えていました。詳細に質問すると、彼は約4週間前から断続的に存在している、全頭部に圧迫感がある鈍い痛みを説明しました。同じ期間に彼の慢性的な背中の痛みも悪化しました。これらの問題のために、彼は最初に毎週のチェスナイトへの参加を止め、その後家族との週末の遠足も止めました。時間が経つにつれ、彼は家族や家庭のためのどんな仕事もしなくなりました。彼は過去3日間仕事を休んでいました。徹底的な身体検査では異常は見つかりませんでした。指示的な質問で初めて、患者は過去数週間ずっと疲れ果ててエネルギーがなく、通常の活動に対する興味を失い、かつて楽しんでいたことを楽しめなくなったと述べました。彼の食事はもう美味しく感じられず、すでに2.5 kg体重が減少していました。最近では、寝付きが悪くなり、毎朝4時から5時の間に目が覚めるようになり、これを頭痛のせいだと考えていました。妻も指示的な質問で、夫がしばしば悲しそうに見え、何の理由もなく涙を流しているのを何度も見たと述べました。彼女には、普段は仕事に対して非常に責任感のある夫が、なぜ現在の3日間の欠勤が仕事の安定性や家族の経済的将来にどのような影響を及ぼすかを常に心配しているのか理解できませんでした。中毒歴と過去の精神医学的歴史は陰性でしたが、家族歴には陽性がありました。患者の父方の祖父が不明な理由で自殺したということです。
家庭医は初めてのうつ病エピソードと診断し、患者と妻にそれぞれ別々の面接でこの診断を知らせ、症状の性質を病気として説明し、回復の良い予後を強調しました。彼女は患者に2週間の休業を命じ、毎朝1〜2時間の散歩をするように勧めましたが、それ以上のタスクや活動は行わないように言いました。急性肺炎のアナロジーを通じて急性うつ病を説明されたときにのみ、患者は一時的な病人の受動的役割を受け入れることができました。患者と家庭医は抗うつ薬を服用することに同意し、彼女はノルトリプチリン(150 mg/日)を処方しました。この薬剤はセロトニン作動性およびノルアドレナリン作動性の特性を持ち、痛みに対して追加の有益な効果が期待できるためです。ドライマウス以外に薬剤はよく耐えられました。患者と家庭医は毎週会いました。治療開始から3週間後、患者は初めて妻の付き添いなしで来院し、自発的に庭仕事を再開したと報告しました。治療開始から合計5週間後、彼はほぼ症状がなくなり、仕事に復帰しました。患者と家庭医は、彼が6か月間ノルトリプチリンを継続して服用することに同意しました。

