表2. 提案されているうつ病のサブタイプの例
| うつ病のサブタイプ | 主な特徴 |
|---|---|
| メランコリックうつ病 (a) | 重度の症状;顕著な神経ベジタティブ異常 |
| 反応性うつ病 (b) | 中等度の症状;外的要因に応じたものと思われる |
| 精神病性うつ病 | 重度の症状;精神病を伴う:例えば、過去の過ちの罰としてのうつ病(妄想)を信じたり、うつ病が当然だとする声を聞いたり(幻覚) |
| 非定型うつ病 | 感情の変動、過眠、食欲増進、体重増加を伴う |
| ディスチミア | 軽度の症状だが、より長引く経過をたどる |
これらのサブタイプは症状に基づいており、生物学的に異なる実体を説明しているわけではないかもしれません。また、これらのサブタイプは一般的に抗うつ薬のさまざまなクラスによる異なる反応によって区別することはできません。
a メランコリックうつ病は、生得的な要因によって引き起こされると推測される「内因性うつ病」として分類される症候群に似ています。
b 反応性うつ病は、外的要因によって引き起こされると推測される「外因性うつ病」として分類される症候群に似ています。
この表の情報はうつ病の多様なサブタイプを示しており、各サブタイプの主要な特徴を説明しています
ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー
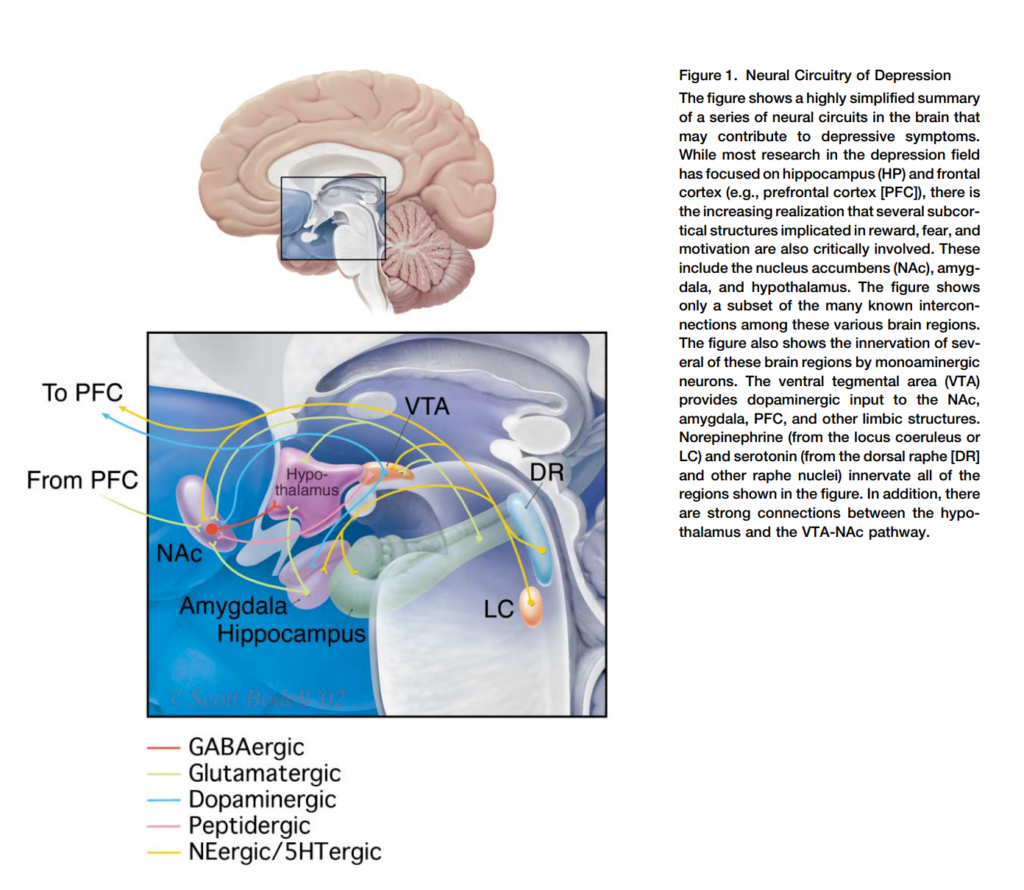
図1. うつ病の神経回路
この図は、うつ病の症状に寄与する可能性のある一連の神経回路の非常に簡略化された要約を示しています。うつ病研究の大部分は海馬(HP)および前頭皮質(例:前頭前皮質[PFC])に焦点を当てていますが、報酬、恐怖、および動機付けに関与するいくつかの皮質下構造も重要な役割を果たしていることがますます認識されています。これらには、側坐核(NAc)、扁桃体、および視床下部が含まれます。この図は、これらの脳領域間の既知の多くの相互接続のうちの一部のみを示しています。
図には、モノアミン作動性ニューロンによるこれらの脳領域の神経支配も示されています。腹側被蓋野(VTA)は、NAc、扁桃体、PFC、および他の辺縁系構造にドーパミン作動性入力を提供します。ノルエピネフリン(青斑核またはLCから)およびセロトニン(背側縫線核[DR]および他の縫線核から)は、図に示されたすべての領域に神経支配を行います。さらに、視床下部とVTA-NAc経路の間には強力な接続があります。
ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー
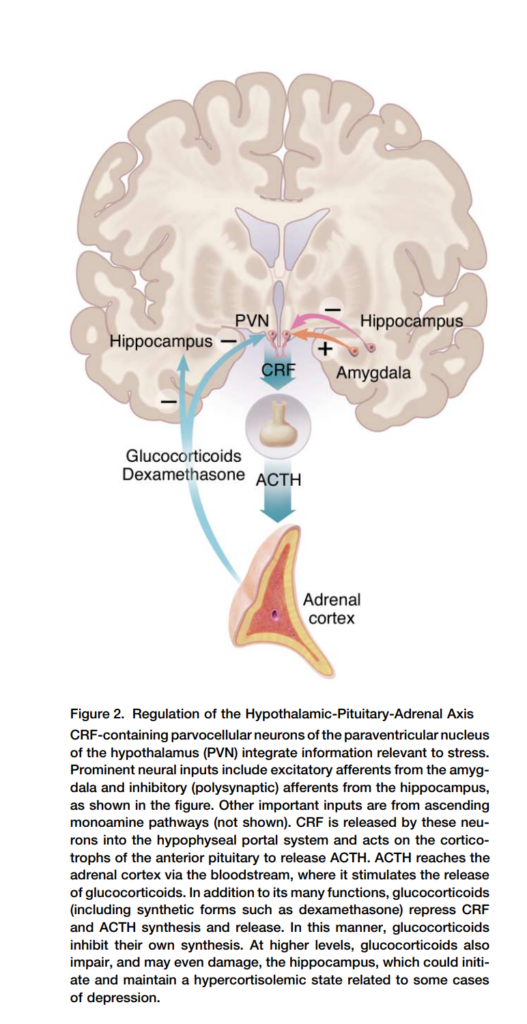
図2:視床下部-下垂体-副腎 (HPA) 軸の調節
この図はHPA軸の調節を示しています。他の重要な入力は上行性モノアミン経路(図示せず)からのものです。CRFはこれらの神経細胞によって分泌門脈系に放出され、下垂体前葉の副腎皮質刺激ホルモン (ACTH) の産生を促進します。ACTHは血流を介して副腎皮質に到達し、そこでグルココルチコイドの分泌を刺激します。グルココルチコイド(デキサメタゾンなどの合成形態を含む)は、CRFとACTHの合成と放出を抑制することで自己調節機能を果たします。このようにして、グルココルチコイドは自己の合成を抑制します。高濃度のグルココルチコイドはまた海馬の機能を損なわせる可能性があり、一部のうつ病症例に関連する高コルチゾール血症状態を引き起こし、維持する可能性があります。
図には、視床下部の室傍核 (PVN) でのCRFの分泌と、ACTH、コルチゾール、β-エンドルフィンの抑制のメカニズムが示されています。視床下部以外の脳領域においてもCRFは重要な役割を果たします。
このモデルは、HPA軸の異常がうつ病の主原因であるか、他の初期原因に次ぐものであるかは依然として不明であるにもかかわらず、HPA軸の異常が特定のうつ病の症状の生成に寄与し、病気の経過およびその身体的続発症に影響を与える可能性が高いとされています。
CRF受容体拮抗薬の新しい抗うつ治療薬としての使用が強く支持されており、CRF1受容体拮抗薬はストレスに基づくいくつかの動物モデルで抗うつ効果を示しています。
ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー
要約: うつ病の神経生物学
うつ病は最も広く認識されている精神疾患の一つであり、重度のうつ病はアメリカ人口の2%から5%に影響を与え、軽度のうつ病はさらに多くの人々に影響を及ぼします。うつ病は女性に多く見られ、遺伝的要因と環境的要因の両方がそのリスクに寄与します。遺伝的リスクは40%から50%であり、多くの遺伝子が関与している可能性がありますが、特定の遺伝子異常はまだ確定されていません。
診断と症状
うつ病は「診断と統計マニュアル(DSM-IV)」の基準に基づいて診断されますが、診断は客観的な検査ではなく、症状に基づいています。主要な症状には抑うつ気分、自己評価の低下、集中力の低下、食欲変動、睡眠障害、エネルギーの低下、興味喪失、そして死や自殺に関する反復思考が含まれます。うつ病は単一の疾患ではなく、さまざまな原因と病態生理を持つ異種症候群と考えられています。
遺伝と環境の影響
うつ病のリスクの約40%から50%は遺伝的要因によるものであり、残りはストレスや感情的なトラウマ、ウイルス感染などの非遺伝的要因によるものです。うつ病エピソードは多くの場合、ストレスの文脈で発生しますが、ストレスだけではうつ病を引き起こすのに十分ではありません。したがって、遺伝的素因と環境要因の相互作用が重要です。
治療法
うつ病の治療には多くの効果的な方法があります。抗うつ薬や電気けいれん療法(ECS)、心理療法(特に認知行動療法)は、軽度から中等度の患者に対して効果的です。抗うつ薬の発見は偶然によるもので、三環系抗うつ薬とモノアミン酸化酵素阻害薬(MAOI)がその例です。これらの薬剤は、脳内のセロトニンやノルエピネフリンの再取り込みを阻害し、抗うつ効果を発揮します。
脳の神経回路とうつ病
うつ病の神経生物学的理解には、脳の特定の領域の役割を解明することが含まれます。例えば、前頭前野、海馬、扁桃体、視床下部などが含まれ、これらの領域は記憶障害、無価値感、絶望感、アヘドニア(快楽減退)、不安、モチベーションの低下などのうつ病の症状に関与しています。脳のこれらの領域は相互に連結され、複雑な神経回路を形成しています。
動物モデル
うつ病研究の主要な障害の一つは、妥当な動物モデルの欠如です。多くのうつ病の核心的な症状(例えば、抑うつ気分、無価値感、自殺念慮)は動物では測定が難しいです。そのため、既存の動物モデルは抗うつ薬の作用やストレスへの反応に基づいています。これらのモデルは、新しい薬剤の抗うつ効果を予測するのに有効であり、ストレスや抗うつ薬の反応を研究するための有用なツールです。
結論
うつ病の神経生物学的理解はまだ発展途上にあり、多くの研究が必要です。現在の治療法は症状の改善に役立ちますが、完全な治癒には至りません。うつ病の原因と治療法の理解を深めるためには、さらなる研究が必要です。
表3:抑うつ研究に使用される動物モデルの例
| モデル | 主な特徴 |
|---|---|
| 強制水泳試験 | 抗うつ薬は動物が水の中で足掻く時間を増加させる。足掻かないことは絶望状態を示すと考えられる。 |
| 尾懸垂試験 | 抗うつ薬は動物が尾で吊られた時に足掻く時間を増加させる。足掻かないことは絶望状態を示すと考えられる。 |
| 学習性無力感 | 不可避な足ショックにさらされた動物は、後に可避な足ショックにさらされたときに逃避するのに時間がかかるか、全く逃避しない。抗うつ薬は逃避までの時間と失敗を減少させる。 |
| 慢性軽度ストレス | 動物は冷却、昼夜サイクルの乱れ、足ショック、拘束などの予測不能なストレスに繰り返しさらされると、砂糖水の摂取や性行動が減少する。しかし、これらの終点は特にマウスでは再現が困難である。 |
| 社会的ストレス | 動物は優位なオスの近くや捕食者の匂いにさらされるなど、さまざまな社会的ストレスにさらされると行動異常を示す。しかし、これらの異常は特にマウスでは再現が困難である。 |
| 幼少期のストレス | 若い頃に母親から引き離された動物は、大人になると持続的な行動およびHPA軸の異常を示し、一部は抗うつ薬治療で改善される。 |
| 嗅球切除 | 化学的または外科的に嗅球を損傷すると、行動異常が生じ、その一部は抗うつ薬治療で改善される。 |
| 恐怖条件付け | 動物は以前に中立的な合図(例:音)または文脈(例:ケージ)と結び付けられた嫌悪刺激(例:ショック)にさらされると、恐怖のような反応を示す。 |
| 不安ベースの試験 | 動物が特定の環境(例:開けた空間、明るく照らされた場所、高所)を探索する度合いは、抗不安薬(例:ベンゾジアゼピン)によって増加する。 |
| 報酬ベースの試験 | 動物は、古典的条件付けおよびオペラント条件付け試験で、薬物乱用薬(または食物や性などの自然報酬)に対して非常に再現性の高い反応を示す。 |
| 認知ベースの試験 | 動物が特定の状況で注意を払ったり、学習したり、記憶したりする能力が測定される。 |
この表は、抑うつ研究で使用される主な動物モデルの特徴をまとめています【17:2†source】。

