新規抗不安薬の標的としての受容体
不安障害は非常に蔓延しており、生活に支障をきたす障害であり、一般に薬物療法および/または心理療法で治療されます。ベンゾジアゼピンは急性不安状態の治療に非常に価値がありますが、よく知られている副作用プロファイルによって長期使用が妨げられています。一方、抗うつ薬は不安障害に対する第一選択の治療選択肢です。しかしながら、それらの作用の発現が遅いことは、これらの疾患におけるそれらの使用にとって不利である。したがって、作用の発現が速く、副作用プロファイルが良好な新規の抗不安薬が必要とされています。現在、γ-アミノ酪酸A型(GABA)の復活が起こっています。あ)新規抗不安薬開発の標的としての受容体。プレガバリンなどの構造的に GABA に関連する化合物はすでに大規模な臨床開発に入っていますが、GABA トランスポーター阻害剤、サブタイプ特異的ベンゾジアゼピンおよび GABAあ 受容体を調節する神経活性ステロイドは、有望な新しい候補です。ただし、その臨床効果はまだ臨床試験で示される必要があります。
不安障害は頻繁に発生し、社会経済的影響が大きい障害を引き起こす(Nutt et al. 2002; Kessler et al. 2006)。これらはプライマリケアで最も頻繁に見られ、かなりの程度の過小診断が行われ、さらに過小治療が行われています。 DSM-IV によれば、全般性不安障害 (GAD)、広場恐怖症を伴うまたは伴わないパニック障害、社交不安障害、特異的恐怖症、および心的外傷後ストレス障害 (PTSD) は不安障害として分類されており、現在のガイドラインによれば、心理療法で治療されます。特に、認知行動療法、薬物療法、またはその両方の組み合わせが効果的です (Bandelow et al. 2002)。
ベンゾジアゼピンは、急性不安状態の治療および緊急治療薬としてのゴールドスタンダードとして確立されています (Bandelow et al. 2002)。これらは非常に効果的な抗不安薬であり、かなり安全です。主な利点は、作用の開始が速いことです (Ballenger et al. 1988)。しかし、急性投与後の鎮静や筋弛緩、エタノール効果の増強などの副作用、さらには耐性の発現、離脱問題、乱用の可能性などが媒体としての使用を妨げています。
不安障害の長期治療の選択肢。一方、選択的セロトニン再取り込み阻害剤(SSRI)や選択的セロトニン/ノルエピネフリン再取り込み阻害剤(SNRI)などの抗うつ薬は、不安障害の第一選択治療選択肢とみなされている(Bandelow et al. 2002)。それらの利点は、耐性効果と乱用の可能性がないことを考慮した臨床効果です。ベンゾジアゼピンとは対照的に、作用の発現がかなり遅いため、治療開始時にベンゾジアゼピンの追加が必要になることがよくあります。不安障害の薬物療法に関する現在のガイドラインは、世界生物学的精神医学会連合 (WFSBP) (Bandelow et al. 2002) および英国精神薬理学協会 (Baldwin et al. 2005) によって最近提供されました。さらに、不安障害に対して現在利用可能な治療法に関する詳細なレビューが最近他の文献で発表されました (Baldwin and Polkinghorn 2004)。
新しい抗不安薬は、ベンゾジアゼピンの利点、つまり高い抗不安効果と迅速な作用発現を維持しながら、耐性効果などの副作用を回避することを目的とすべきです。
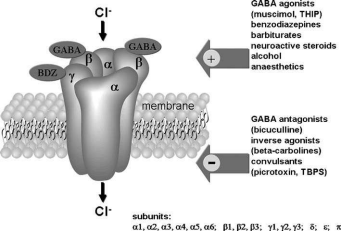
GABAの分子薬理学あ 受容体
フロントあ 受容体は、4つの膜貫通ドメインを持つリガンド依存性イオンチャネルのファミリーに属し、ニコチン性アセチルコリン、セロトニン3型およびグリシン受容体とかなりの相同性を共有しています(Moèhler et al. 2001; Whiting 2003; Bellelli and Lambert 2005)。これらは、通常、a、b、g サブユニットを含む五量体を形成するさまざまなサブユニットで構成されています (図 1)。ただし、GABA の異種発現に関する研究で、 受容体サブユニットは、b サブユニットの存在が機能的なリガンド依存性塩素チャネルを構成するのに十分であることを明らかにした(Puia et al. 1990)。最も豊富な a、b、および g サブユニットに加えて、他のサブユニット (d、o、p、および u) が知られており (Mohler et al. 2002)、これらは組織特異的受容体の発現に重要です。
さまざまな化合物がGABAに作用する受容体、例えば、GABA結合部位のアゴニストおよびベンゾジアゼピンなどのアロステリックモジュレーター。ベンゾジアゼピンの異なる薬理は、主にサブユニットの発現の変動によって決定されます (Mohler et al. 2002)。現在、6 つの a サブユニット (a1 a6) が知られています。新規の抗不安化合物の開発にとって興味深いのは、さまざまなαサブユニットは、抗不安作用、抗けいれん作用、鎮静作用、または筋弛緩作用に関して、ベンゾジアゼピンの異なる薬理学的特性を与えます。ベンゾジアゼピンのこのような異なる効果は、部分的には単一のアミノ酸によって決定されます。例えば、a1 サブユニットの 101 位のヒスチジンはベンゾジアゼピンの GABA 増強効果に重要ですが、a6 に存在する 101 位のアルギニンはベンゾジアゼピンによる GABA 応答の減少につながります (Wieland et al. 1992;モーラーら、2002)。 GABA 結合部位はムシモルで標識することができ、b タイプのサブユニットとともに位置します。ベンゾジアゼピンの薬理学にとって a サブユニットの重要性にもかかわらず、a g サブユニットの存在はベンゾジアゼピンの GABA への結合にとって重要であると考えられます。受容体 (Mohler et al. 2002)。
ノックアウトおよびノックイン技術の使用は、さまざまな GABA の生理学的役割を特徴付けるのに役立ちました。ベンゾジアゼピンの作用に対する受容体サブユニットが生きている。 g2 サブユニットを完全にノックアウトしたトランスジェニック マウスは生存できません。しかし、ヘテロ接合マウスは g2 サブユニットの発現低下を示し、ジアゼパムの抗不安薬様作用に対してより感受性が高くなります (Crestani et al. 1999)。これらのマウスは、フルマゼニルの結合の減少を考慮して、不安関連行動の強化と自然の嫌悪刺激に対する行動抑制の強化を示します。このような所見は、パニック障害患者で得られた所見とよく似ています。

