2 うつ病と認知症
システム神経科学と精神医学の紹介
神経科学、遺伝学、エピジェネティクス、遺伝子と環境の相互作用を概念的に理解することは、精神疾患をより深く理解するのにどのように役立つでしょうか?表面的には、精神疾患の現在の臨床診断と管理には、「中枢報酬系」や「中枢神経系 (CNS) の可塑性」などの概念を理解する必要がないように見えるかもしれません。それにもかかわらず、精神科医やその他の精神保健専門家は、診断と治療における状況の変化に適応するための知識を備えていなければならないと私たちは信じています。今後数十年にわたって、脳研究は、精神疾患についての考え方や、脳機能の特定の欠陥の修正を目的とした、よりメカニズムに基づいた治療法やリハビリテーション戦略を目指した治療戦略の開発方法に大きな影響を与えると私たちは考えています。したがって、変化する臨床環境に適応するには、この分野の神経科学の基礎に関する確固たる知識ベースが必要となります。これは、現在の精神科医やこの分野に参入する学生には明らかではないかもしれませんが、神経科学の新たな進歩が根付くにつれて明らかになるでしょう。
この章の目的は、神経科学や遺伝学など、臨床に関連する基礎科学の概念的な理解が、明日の診断システムと治療法を理解するためにどのように不可欠であるかを説明することです。説明の目的で、大うつ病と認知症という 2 つのグループの障害に焦点を当てます。うつ病は、精神科医が治療する最も一般的な病気の 1 つです。アルツハイマー病は認知症の最も一般的な原因であり、神経機構の観点から最もよく特徴づけられている精神神経疾患の 1 つです。アルツハイマー病における分子、細胞、およびシステムの神経科学メカニズムの理解における科学の進歩は非常に有益であり、原発性精神疾患に寄与するメカニズムを概念化するためのより良い方法につながる可能性があります。
システム神経科学と精神医学に関するいくつかの基本概念
扁桃体や側坐核(「大脳辺縁系」の一部)などの進化的に古い脳領域の一部は、主に感情やモチベーションに関連する情報の処理と統合に関与しています。これらの領域は、私たちの外界と内界に関する情報を受け取り、入ってくる情報に意味を持たせることで状況を迅速に評価するのに役立つ応答を生成します。他の相互接続された脳領域、特に最近進化した新皮質の領域は主に認知処理に関与しており、意識的に考え、意思決定を計画し実行することを可能にします。これらの例では、特定の脳領域の集合が互いに直接接続され、常に相互に通信し、脳システム (またはネットワーク) を形成しています。一部の脳構造は、複数の脳システムに属しています。たとえば、海馬は、認知および動機付けの脳システムだけでなく、感情の処理にも関与しています。一方で、個々の脳システムは単独では機能しません。例えば、感情処理脳システムは、人が感情(アントニオ・ダマシオの言葉では「感情」と呼ばれる)を意識し、感情から学び、さらにはトップダウン処理によって感情を制御するために、認知処理脳システムを必要とする。したがって、感情システムは、前頭前皮質、頭頂皮質、側頭皮質などの脳領域が関与する認知システムと密接に相互作用します。
感情および認知処理システムに加えて、報酬と動機に関連する経路が人の感情と行動の決定と制御に関与しています。人は、特定の行動がどれだけやりがいがあるか、またその行動に関連して認識されるコストに応じて行動を変えます。何かの感じ方が気に入った場合、私たちはその感情を長引かせるための措置を講じます。ある食べ物の味を楽しむと、もっと食べたくなるものです。株式市場で良い成績を残せれば、今後も株式投資を続けていきたいと考えています。興味深いことに、株式市場で突然成績が悪くなった場合、損失に比例しない反応が起こる可能性があります。このような決定は多くの場合、認知的にではなく感情的に行われます。悪い結果、または悪い結果と認識されると、行動に大きな影響を与える可能性があり、恐怖や不安などの否定的な感情を処理する脳の中枢が刺激される傾向があります。時にはこれが適切であり、防御的な行動を取ることもありますが、時にはそれが不適切であり、間違った決断や対人関係の問題につながることもあります。
臨床的うつ病に関連する症状には、感情処理、認知、報酬の基礎となるシステムの異常な機能が含まれます。私たちはこれらの障害を「気分の問題」として分類しますが、認知や動機を含む心のあらゆる側面にわたって欠陥が発生することを認識することが重要です。これらのシステムが連携して機能しない場合、人間の脳は、悲しみ、日常の環境や活動への関心の低下、集中力の低下や不注意、食欲や睡眠の変化、エネルギーやモチベーションの低下など、さまざまな症状を引き起こします。 、そして時には、生きる意欲の欠如や自殺願望もあります。うつ病症候群は、1 つまたは少数の脳構造や 1 つまたは少数の神経伝達物質系の異常を反映するものではありません。これは、複雑で分散されたマルチネットワークの問題を反映しています。これについては、第 5 章で詳しく説明します。
これらの脳システムの機能不全には、さまざまな理由が考えられます。一部の人々は、これらの特定の脳ネットワークを混乱させることが難しい遺伝子構造を持っています。そのような人々は回復力が高く、逆境に直面してもうつ病になりにくいです。他の人は配線された脳を持っています
つまり、わずかな混乱でも重大な混乱を引き起こし、行動の変化につながる可能性があります。遺伝子がうつ病になりやすい素因に大きく寄与していることは疑いの余地がありません。一部の家族は他の家族よりもうつ病のリスクが高くなります。これらのリスクには、多くの一般的な遺伝子による小さな影響、またはまれな遺伝子変異による大きな影響が含まれる可能性があります。脳システムを混乱させるさまざまな要因については、第 9 章で説明します。
うつ
DSM-IV の診断名である「大うつ病」は、広範かつ不均一なカテゴリーの障害を指し、「がん」という用語とやや類似した用語です。友人ががんを患っていると告げられたとき、私たちはがんの種類を知りたくなります。それは治療や余命に大きな影響を与える可能性があるからです。同様に、患者にうつ病の病歴がある場合、臨床医はどのようなうつ病であるかを知りたいと思うはずです。この質問に対する答えは、治療の決定と病気の予想される経過に大きな影響を与えるからです。私たちの現在の診断システムでは、さまざまなタイプの機能障害が「大うつ病」という見出しの下にまとめられています。これにより臨床実践が簡素化される一方で、疾患の根底にある生物学を理解し、個々の患者にとって最も効果的な治療戦略を考案することには大きな困難が生じます。以下に異質性の例をいくつか挙げます。
うつ病患者の中には、「純粋な」病気、つまり家族内で発症し、他の精神疾患や主要な環境ストレス要因から独立したタイプのうつ病を患っている人もいると思われます。このタイプの「純粋な」うつ病を患う若者は、数週間にわたって重度のうつ病症状の発症を経験し、学業、仕事、人間関係に支障をきたすことがあります。この人の家族歴から、同じ治療アプローチ、たとえばブプロピオンと認知行動療法の併用などにそれぞれよく反応した可能性のある近親者に同様の病気があったことが判明する可能性があります。このような場合、患者も同様の治療に反応する可能性が高くなります。この人が受け継いだ特定の遺伝子グループは、感情の処理や気分の調節に関与する神経系の円滑な機能に脆弱性をもたらしている可能性があります。理論的には、ブプロピオンと心理療法は、これらのシステムの健康な活動、接続性、相互作用を再確立するのに役立ち、臨床的改善につながります。
このような家族性の高い大うつ病性障害を患う個人では、脳の構造と機能に重大な変化があることを強く示唆するデータがあります。例えば、コロンビア大学のブラッド・ピーターソンらによる最近の研究では、家族が複数世代にわたって大うつ病を患っている人の右頭頂皮質の特定の領域でかなりの薄化(25%以上の薄化)が見られることが実証された。認知に関与する領域におけるこの右側の皮質の薄化は、注意の集中や視覚的記憶の問題(認知欠陥)、およびうつ病(感情に基づく病気)の家族リスクと相関していました。これらの最近の発見は、感情処理ネットワークの一部である前帯状皮質下領域の構造変化、その領域のグリア細胞の喪失を含む変化を実証した家族性うつ病に関する以前の研究に基づいている。これらの発見は、うつ病の素因となる遺伝子異常の一部が脳の重大な構造変化と関連している可能性があることを示唆しています。このような変化は、特定の脳システム内および脳システム間の接続に影響を及ぼし、接続におけるこれらの変化が気分障害のリスクに寄与する可能性があります。後続の章で説明するように、脳の構造と機能の変化がどのようにして起こるのか、またそれらが実際に因果関係による変化なのか病気の結果なのかは現時点では不明ですが、小児や青少年を対象とした研究では、少なくとも脳の変化の一部が変化していることが示唆されています。重大な臨床症状が起こる前に起こります。重要な点は、これらの変化は特定の型のうつ病に関連しており、必ずしも他の型のうつ病に見られるわけではないということです。
別の臨床シナリオには、10 代の頃にコカイン依存症を発症した患者が含まれる可能性があります。この患者は、コカインによるハイ状態からの脱却と時間的に関連した、重度の短期間のうつ病症状で何度か救急外来を受診しました。毎回、彼の症状は劇的で、重大な自殺念慮を伴うものでしたが、特別な介入なしに数時間で治まりました。数年間のコカイン中毒の後、患者は再び重度のうつ症状で緊急治療室に運ばれたが、今回はハイ状態から抜け出したときに症状が以前ほど早く解消しなかった。彼の臨床症状には、自殺念慮を含むあらゆる範囲の抑うつ症状が含まれていました。彼は病院に入院したが、抑うつ症状は数日間続いた。自殺願望が解消されたため、患者は化学物質依存症を管理するための宿泊治療プログラムに移されました。 3週間のコカイン禁欲とグループ療法の後、うつ症状は解消した。彼はコカインを使用したいという強い願望を持ち続けましたが、自分の依存症と、コカイン依存症と気分症状との関係についての洞察を深め始めました。彼は再発するまでの 3 か月間はきれいな状態を保っていました。その 3 か月間、彼はうつ病の症状を経験しませんでした。
この人は 2 つのタイプのうつ病症候群を示しており、それらは家族性大うつ病患者に観察される症状とまったく同じくらい深刻です。救急治療室への以前の症状は、コカインからの薬理学的離脱によるものでした。この離脱により、気分調節に関連する神経系の 1 つまたは複数が急激に混乱しました。これはおそらく、動機付けの処理に関与し、コカインなどの乱用薬物の主な標的であるドーパミン伝達系の異常な機能に関係していると考えられます。この混乱は深刻であり、コカインハイから抜け出すことによる短期的な影響と時間的に関連していた。重度ではありましたが、うつ病の症状は数時間しか続きませんでした。この症候群は大うつ病の診断には当てはまりませんが、神経系の混乱が深刻なうつ病のような症状を引き起こす可能性があることを示しています。数年後に発生した長期にわたる抑うつ状態は、持続的なコカイン依存症の結果として生じた患者の中枢報酬系の長期にわたる調節不全に関連している可能性が高い。この場合、うつ病症候群は数週間続きましたが、数週間の行動療法とコカインの禁欲により徐々に解消されました。
初期の用語では、ワシントン大学セントルイス校のイーライ・ロビンスとサム・グゼが支持していた。ルイス、このより持続性のうつ病症候群は「二次性うつ病」と呼ばれます。これは、うつ病が中毒性障害の発症後に発生したものであり、時間的にはコカイン依存症に「二次的」であったことを意味します。重要なのは、コカイン依存は持続的な気分症状が発症する前にすでに進行しており、したがって気分の調節や認知に関与する脳ネットワークを含む脳ネットワークに重大な影響を与えていたことです。ただし、「二次性うつ病」という用語は因果関係を示唆するものではないことに注意してください。それは、薬物乱用の発症後のある時点でうつ病症候群が発生したことだけを示しています。対照的に、「原発性」うつ病は、既存の精神疾患や重篤な医学的疾患がないにもかかわらず発生するうつ病です。我々は、この区別が概念的に有用であると信じている。なぜなら、コカイン依存に関連したうつ病を、前述の高度に家族性の(「原発性」)気分障害から区別することを含めて、うつ病のサブタイプを区別するのに役立つからである。これは、うつ病や機能不全につながる神経経路が異なる可能性があることも強調しています。提示された例では、「一次」うつ病は感情処理システムの顕著な変化(例えば、帯状皮質下皮質、新皮質、扁桃体の機能異常とおそらく細胞喪失)を伴う可能性が高く、「二次」うつ病はコカインの状況で発生しました。 – 動機/報酬システムの変化を誘発する。さらに、さまざまな種類のうつ病の治療は、根底にある脳機能障害に合わせて行われるべきであると主張します。このことを認識できていないことが、STAR*D などの最近の大規模臨床有効性試験で観察された全体的な寛解率の低下の一因となっている可能性があります。この試験では、発症年齢の若さと精神医学的および医学的併存疾患の高さが、より悪い転帰の予測因子でした。
コカイン依存症の患者の抑うつ症状は治まったが、コカインへの渇望は治まらず、居住型治療センターから退院して数か月後にはコカインの使用に戻った。数年後、彼はうつ症状とコカイン中毒の治療のため再び入院した。しかし今回は、数週間禁酒しても彼のうつ症状は改善しなかった。薬物依存症を居住施設でさらに1か月間治療した後、彼は何年も禁欲を続けることができた。しかし、彼の抑うつ症状はさらに持続しました。最終的に、このうつ病性障害は、薬物療法、心理療法、食事、運動、断薬などのライフスタイルの変化を組み合わせることで反応を示しました。薬物中毒の生物学について私たちが学んでいることに基づくと、この患者の長期にわたる物質依存は、彼の中枢報酬系や感情処理システム、認知システムに構造的および機能的変化をもたらした可能性があります。このような変化には、神経系の機能回復を助ける薬理学的、心理的、およびライフスタイルの介入が必要でした。
これら 2 つのシナリオを、躁状態とうつ病の両方のエピソードを特徴とする双極性障害患者に頻繁に観察されるうつ病と比較してください。双極性うつ病の人は、前の 2 つのケースに関係するものと重複する脳システムの異常を抱えている可能性がありますが、これらの異常は双極性障害を引き起こす神経機構に起因します。双極性障害は、典型的には家族内で発症し、時にはうつ病を呈する病気です。そして精神病的な特徴。双極性障害の原因は不明ですが、抗うつ薬とは対照的に、気分安定薬が治療の最初の選択薬カテゴリーです。適切な治療には、気分安定剤と抗精神病薬の併用、また必要に応じて、良好な睡眠習慣や概日リズムを軌道に乗せるためのその他の習慣の重要性についてのトークセラピーや教育が含まれる場合があります。興味深いことに、一部の人では双極性障害が時間の経過とともに悪化する傾向があり、病気のエピソードがより頻繁になり、エピソード間の健康な期間が短くなるという証拠があります。このことから、ロバート・ポストらは、これらの人々に「キンドリング」または行動的感作現象が起こっていると提案し、「抗キンドリング」気分安定剤として抗けいれん薬の試験を実施した。また、従来の抗うつ薬は双極性障害の経過を悪化させ、一部の患者の不安定性をさらに悪化させる可能性があるようです。したがって、双極性障害の脳生物学は、以前に概説したうつ病のシナリオとは異なる可能性があります。双極性障害は「原発性」気分障害の一種であり、おそらくすべてではないが一部のメカニズムを原発性大うつ病と共有していることにも注意してください。例えば、双極性障害の被験者は帯状皮質下皮質の縮小と細胞の喪失を持っていますが、明らかに非双極性気分障害とは異なる病気の特徴を持っています。
これらは、臨床現場で日常的に遭遇するうつ病のさまざまな「タイプ」のほんの一部にすぎません。他の例には、パーソナリティ障害(境界性パーソナリティ障害や身体化障害など)や重篤な医学的疾患(心臓病、がん、糖尿病など)に関連して生じるうつ病が含まれます。これらの障害の症状はすべて似ていますが、根底にある脳のメカニズムは異なる可能性があります。さらに、適切な治療法は、臨床表現型ではなく、症候群の原因に応じて異なる可能性があります。私たちの例の患者は通常、DSM-IV にリストされている症状を数週間経験しました。しかし、症状の引き金は異なり、他の変数(例えば、コカイン乱用の期間)に応じて、同じ個人内でも時間の経過とともに変化することさえありました。神経科学の観点から見ると、臨床症状は特定の脳ネットワークの機能異常に起因します。一方、治療は、リハビリテーション治療と原因に基づく治療という 2 つの大きなカテゴリーに分類されます。リハビリテーション治療は病気の病因に特有のものではありません。それらは、機能不全に陥ったシステムを回避または最小限に抑える方法で脳に影響を与えることによって症状を軽減します。たとえば、特定の心理療法では、異なる考え方を訓練することでうつ病の症状を最小限に抑える方法を人々に教えています。この新しい学習により、臨床改善を促進する脳回路が確立または再確立される可能性があります。原因に基づいた治療は、壊れた回路を直接修復します。現在の抗うつ薬や気分安定剤は原因に基づいた治療法ではありません。むしろ、これらの薬は、たとえ機能不全に陥った回路の主な欠陥が実際には修復されなかったとしても、特定の機能不全に陥ったシステムの機能を強化することによって作用する可能性が高い。私たちが強調したい重要な点は、DSM-IV「大うつ病」は非常に多様な一連の疾患であるということです。うつ病に関与する神経回路が病気のサブタイプ間で同じであるか、異なるのかはまだわかっていません。可能性が非常に高いと思われるのは、うつ病につながる神経経路がサブタイプによって異なる可能性があり、これが診断と治療についての考え方に実際的な影響を与えるということです。私たちは、すべてのうつ病をひとまとめにすることは、すべてのがんや認知症疾患をひとまとめにすることと同様に意味がないと考えています。これら後者の点をより鮮明にするために、認知症疾患の病理生物学の理解における最近の進歩、つまり、効果的な治療戦略が因果関係の分子機構をターゲットにしながら、脳ネットワークの機能不全がどのように臨床症状を引き起こすかを図的に浮き彫りにする進歩に注目したいと思います。
認知症
アルツハイマー病の理解は大きく進歩しました。原発性精神疾患とは対照的に、「アルツハイマー病」という用語は、解剖時の脳検査まではまだ最終的に確認できない、特定の病理に基づいた診断を指します。したがって、アルツハイマー病が臨床的に疑われる場合、根底にある病理学的プロセスについての不確実性を反映して、「アルツハイマー型認知症」(DAT)と診断されます。 DAT の臨床表現型と経過は詳しく説明されており、アルツハイマー病の根底にある脳の構造異常もよく特徴付けられています。もう 1 つの明確に定義された認知症は、行動変異型前頭側頭認知症 (bvFTD) として知られています。 DAT および bvFTD に関する最近の研究により、臨床症状 (表現型) と原因 (分子機構) との関係が明らかになりつつある情報が提供されています。このセクションでは、両方の認知症の臨床像を簡単にレビューします。さらに、デフォルト システムと感情顕著性システムという 2 つの脳ネットワークに関する最近の情報と、これらの神経ネットワークが病気にどのように寄与していると考えられるかについても説明します。このような中核となる神経システムは、一部の神経科学者によって「固有接続ネットワーク」(ICN) と呼ばれており、これらの ICN は特定の種類の情報を処理すると思われます。認知症疾患の兆候を示していると考えられる個人のバイオマーカーを測定することによって、治療に直接影響を与える可能性のある情報が得られることもあります。私たちは、これら 2 つの認知症の臨床表現型、神経系、原因から得られた情報は、他の精神疾患の理解に多大な影響を与えると考えています。 「ICN」という記述子は、すべての神経科学者が使用しているわけではないことに注意しますが、私たちはこの用語を好み、本書全体で使用します。これらのネットワークを「休止状態接続ネットワーク」または「機能接続ネットワーク」と呼ぶ人もいます。
アルツハイマー型認知症
DAT は、記憶、思考、実行機能 (意思決定)、学習、性格などの多くの脳機能が徐々に低下することを特徴としています。これは加齢とともにますます一般的になる疾患であり、85 歳以上の人口の約半数が DAT の症状を示しています。 DAT 患者の脳には、ベータアミロイドと過剰リン酸化タウという 2 つのポリペプチド (タンパク質) の蓄積に関わる特徴的な構造変化があります。ベータアミロイドは細胞の外側に蓄積し、アミロイド斑と呼ばれる目に見える微細構造を形成します。タウは、ニューロン内の分子の効率的な輸送に関与する微小管の機能に関与するタンパク質です。過剰リン酸化されたタウはニューロン内に蓄積し、物質を細胞体から細胞の離れた部分(シナプス末端)に輸送する能力を破壊します。蓄積されたタウは、ニューロン内に病的な「もつれ」を形成します。プラークともつれはいずれも、最終的にはニューロンの機能と細胞間コミュニケーションを妨害します。機能の妨害は、ニューロンの喪失と DAT の臨床症状を引き起こします。
特定の特定の脳領域は、DAT の過程で他の領域よりも早く関与しているようであり、この情報は臨床症状がどのように発生し、進展するかについての手がかりを提供します。これらの脳領域には、海馬、嗅内皮質などの海馬付近の領域、および後帯状回近くの脳の後方に位置する新皮質の領域である楔前部のニューロンが含まれます(解剖学的構造を示す脳の構造マップについては付録を参照)これらのエリアの場所)。これらの構造は、「デフォルト」システムと呼ばれるニューラル ネットワークを構成する脳領域と重なっています。このニューラル ネットワークは、機能的に接続されており、広く分散された脳領域の集合です。研究者らは、陽電子放射断層撮影法 (PET) や機能的磁気共鳴画像法 (fMRI) などの神経画像技術を使用して、デフォルト システムに関与する各構造の脳活動が相互に高度に相関していることを示しました (図 2-1 および表 2)。 -1)。このデフォルトの ICN は、ユーザーが特定のタスクに集中していないときに最もアクティブになります (そのため、「デフォルト」ネットワークという名前が付けられています)。このようなとき、デフォルトのシステム内の構造はすべて、相関した活動で一緒にハミングし、記憶、感情、全体的な幸福状態など、主に内部 (自己内) 情報を処理します (表 2-2)。興味深いことに、デフォルトのシステムは、脳の他の領域が「休んでいる」ときに多くのエネルギーを使用し、デフォルトの ICN の領域は人間の脳の中で最もエネルギーを必要とする領域の 1 つです。デフォルトのシステムでは大量のエネルギーが要求されるため、これらの脳領域は DAT の最も初期の損傷を受けやすくなっているようです。さらに、継続的なシナプス活動の要求が、これらの領域をアミロイド沈着に対して脆弱にする重要な要因である可能性があるという証拠があり、現在の考えでは、アルツハイマー病の発症における主な要因としてシナプス機能不全が強調されています。重要な点は、DAT の初期に関与する領域が、特定の脳ネットワークに関与する領域と同じであるように見えることです。このネットワークの機能不全が、少なくとも DAT の初期の臨床症状を引き起こすと主張するのは論理的です。この研究から発展した原則は、特定のネットワーク内で機能不全/変性が発生すると、おそらくシステム内の調整された神経活動の結果として、それがネットワーク内に広がる傾向があるということです。
————————-図 2-1
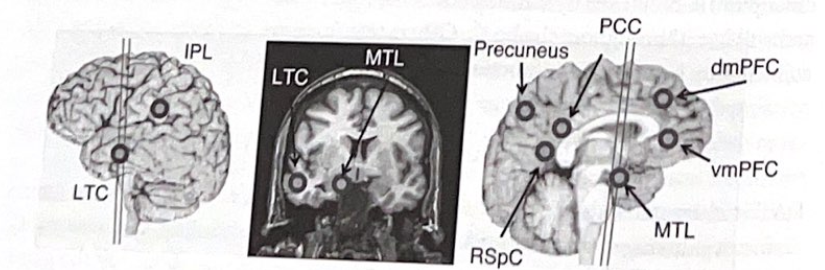
————————-
図 2-1 デフォルト モード ネットワークの主要なノード。この図は、Marc Raichle 氏、Randy Buckner 氏らによって定義されたデフォルト モード ネットワークに関係する主要な構造を示しています。強調表示される領域には、側頭葉外側皮質 (LTC)、下頭頂小葉 (IPL)、楔前部、脾後皮質 (RSPC)、後帯状皮質 (PCC)、背内側 PFC (dmPFC)、腹内側 PFC (vmPFC)、内側側頭葉が含まれます。 (MTL)、海馬を含む。脳の再構成を通る線は、放射線画像に示されるおおよその位置を示します。 (許可を得て、Damasio、2005 年から翻案。)
————————-表 2-1
表 2-1 デフォルト ネットワーク: 主要な構造
側頭葉内側
海馬
嗅内および海馬傍皮質 側頭葉皮質
背内側前頭前野
腹内側前頭前野
後帯状皮質、楔前皮質、および脾後皮質
下頭頂小葉
————————-
行動変異型前頭側頭型認知症
bvFTD は DAT よりもはるかに一般的ではありません。また、若い人に発症する傾向があり、発症年齢は通常50〜60歳です。最も明らかな症状には、社会的行動の重大な変化が含まれます。たとえば、礼儀正しい人でも、公共の場で卑猥なジョークを言ったり、見知らぬ人と過度に友好的になったり、性的に不適切な態度を取ったりするなど、著しく不適切な行動を徐々に示すことがあります。こうした新たに始まった行動は、家族や友人にとっては当惑しますが、通常は本人には認識されません。これらの不適切な行動に伴って、食習慣、性欲、発言の変化など、他の変化が起こることもあります。認知作業はより困難になり、DAT 患者に見られるのと同様の記憶と思考の変化が生じます。
William Seeley らによる最近の報告では、bvFTD 患者の脳には、「感情顕著性システム」として知られる特定の ICN の機能不全が見られることが示唆されています (表 2-3 および図 2-2)。このシステムには、感情と意味の処理を助けるいくつかの辺縁系および皮質脳領域が関与しています (表 2-4)。感情顕著性システムの崩壊の原因には、特定のタンパク質の異常が関与している可能性があります。これらには、TDP-43 (TAR DNA 結合タンパク質 43) と呼ばれるタンパク質、タウの異常型である別のタンパク質、および FUS (肉腫融合) と呼ばれるタンパク質が含まれます。 bvFTD に関与するタウの形態は、DAT で見られる過剰リン酸化タウとは異なります。ただし、まれに、プラークやもつれの形成につながる DAT に関連するタンパク質の異常が、bvFTD の臨床症候群を引き起こす可能性があることに注意することが重要です。これは、アミロイドと過剰リン酸化タウが、一部の人ではデフォルトのシステムではなく感情顕著性システムを選択的に攻撃する可能性があることを示唆しています。興味深いことに、そのような患者は、TDP-43、FUS、または非DAT型のタウによって引き起こされるbvFTDと区別できない臨床症候群を患っています。一部の人では感情顕著性システムがプラークやもつれの病理に対してより脆弱であるのに(結果として bvFTD が発生する)、他の人ではデフォルト システムがより脆弱である(結果として DAT が発生する)のはなぜでしょうか?まだわかりませんが、重要な発見は、病理が特定のICNを攻撃すると、その病理がそのICN全体に浸透し、ICNの機能を反映する特徴的な臨床的特徴を引き起こすようであることのようです。
————————表 2-2
表 2-2 デフォルト ネットワーク: 内部に重点を置いた機能
自伝的な思い出
エンコードと取得
気分とモチベーションの状態
メンタルシミュレーション
未来を「思い出す」
社会的交流
他者の視点を考える(心の理論)
————————-
————————表 2-3
表 2-3 感情顕著性ネットワーク: 主要な構造
前頭島皮質および前島皮質
前帯状皮質
眼窩前島皮質
前頭極皮質
側頭極皮質
扁桃体の拡張
腹側線条淡蒼球
腹側被蓋野/黒質
視床下部と水道周囲の灰色
————————-
————————図 2-2
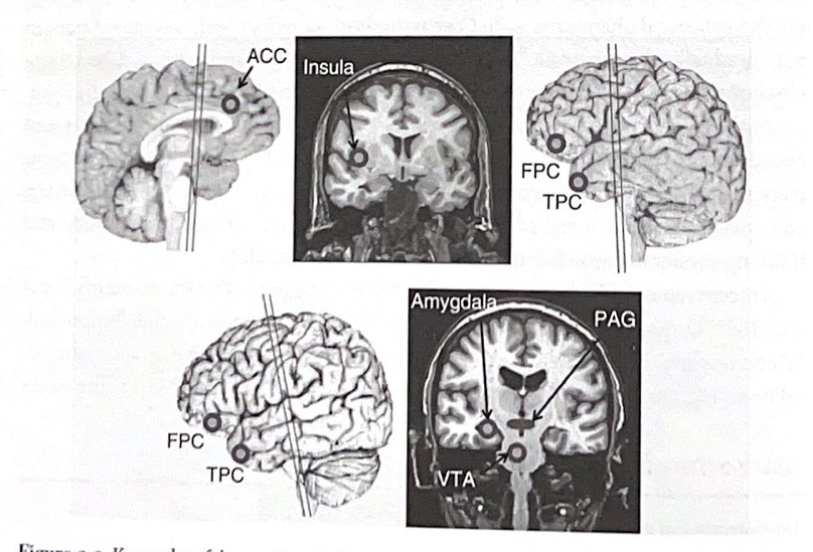
————————-
図 2-2 感情顕著性システムの主要ノード。この図は、William Seeley らによって定義された感情顕著性ネットワークに関与する主要な構造を示しています。強調表示されている領域には、前帯状皮質 (ACC)、島皮質、前極皮質 (FPC)、側頭極皮質 (TPC)、扁桃体、水道周囲灰白質領域 (PAG)、および腹側被蓋野 (VTA) が含まれます。脳の再構成を通る線は、放射線画像に示されるおおよその位置を示します。 (許可を得て、Damasio、2005 年から翻案。)
————————表 2-4
表 2-4 感情顕著性ネットワーク機能
競合の監視
内受容意識
自律神経系の処理
報酬処理
————————-
重要なのは、DAT と bvFTD の両方において、認知症の表現型 (つまり、障害の臨床症状) は、破壊されている特定の神経ネットワークによって定義されるようです。臨床表現型は必ずしもその混乱の生化学的原因を定義するとは限りません。すべてではありませんが、DAT 患者のほとんどは、アミロイド斑とタウもつれの病状を患っています。現在では、生涯にわたるヒトのアミロイド蓄積を実証できる脳画像技術が存在しており(例えば、ピッツバーグ・コンパウンドB[PIB]を使用してアミロイドを標識する)、この研究により、感染リスクの高い個人をより早期に特定できる可能性がある。 DAT とおそらく早期介入。 PIBを使用した研究では、認知的に正常な高齢者の安静時デフォルトモード接続の変化がすでに実証されています。こうした初期の変化が認知症の進行をどのように促進するのか、また、それが認知症の進行を引き起こすのかどうかは、今後重要な検討事項となるだろう。さらに、DAT は脳脊髄液 (CSF) 中のアミロイドレベルの低下とタウレベルの増加に関連しているようであり、その変化は比較的簡単な臨床処置である腰椎穿刺によって評価できます。脳内のアミロイド沈着と同様、これらの変化は臨床症状が現れる前に起こる可能性があります。医師が画像診断やCSFバイオマーカー研究を利用して、表現型DATが脳内のアミロイド斑やCSFアミロイドの減少と関連しているかどうかを判定できるようになる日もそう遠くない。この情報により、医師は個人の DAT がアミロイドと異常なタウによって引き起こされる可能性が高いかどうかを判断することができます。このような変化が何らかの症状の前に特定されると、臨床的 DAT の発症を遅らせたり予防したりできる可能性があります。実際、病理学的レベルのアミロイド(すなわち、疾患の原因と考えられているもの)の初期蓄積を除去することを目的とした治療法が現在試験されている。アミロイドの蓄積がデフォルトシステムの破壊の根本的な原因である場合(まだ確実ではありませんが)、アミロイドの形成を減少させるか、アミロイドの除去を増加させることによって、病気の臨床症状が停止するか、あるいは予防される可能性さえあります。この原因に基づいたメカニズム的治療は、DAT に対する現在の対症療法とは対照的です。サポートと教育は、家族や患者が病気にうまく対処できるよう支援します。これはリハビリテーション治療の一種です。コリンエステラーゼ阻害剤は、脳の 1 つのシステムに影響を与え、症状を短期的に安定させる可能性がありますが、これらの薬剤は障害の実際の原因を治療するものではありません。
画像処理やバイオマーカーの手法を人々に適用することも可能であるはずです。 bvFTD を使用して結果を合理的な治療の基礎として使用します。たとえば、bvFTD 患者の画像検査でアミロイド斑が見られ、CSF でアミロイドの減少が見られる場合、その患者の bvFTD の病因は、一般的に bvFTD に関連する他のタンパク質によって引き起こされるのではなく、アミロイドに基づく可能性が高くなります。これは、抗アミロイド療法がこの特定の bvFTD 患者に役立つことを示唆していますが、これは臨床像のみに基づいて予測することはできませんでした。この例では、臨床表現型は bvFTD になります。しかし、イメージングとバイオマーカー修飾子は、この特定の bvFTD 症例の病因にはアミロイドと過剰リン酸化タウが関与していることを示唆しています。最終的には、CSF または血漿中の他の異常タンパク質 (TDP-43 など) のレベルを測定できる可能性があります。このような測定により、医師は臨床症候群の原因をより具体的に理解できるようになります。臨床表現型は病気の現在および将来の臨床経過を予測しますが、バイオマーカー データは根底にある病理を示唆します。
このような進歩は、うつ病や他の精神疾患にも応用できるようになるのでしょうか?私たちはうつ病の臨床表現型を明確に知っています。うつ病のさまざまな原因についてさらに解明されるにつれて、治療法に関してより具体的なことができるようになるはずです。 DAT や bvFTD と同様に、臨床表現型は主要な病態生理学に関与する特定の脳ネットワークによって決定される一方、異常な機能につながる細胞、シナプス、および分子機構が特定の治療アプローチの標的となる可能性があります。また、特定のリハビリテーションの取り組み(つまり、行動、ライフスタイル、心理療法戦略)が、障害に関与した脳ネットワークの機能を回復することに向けられる可能性があると想像することもできます。
同様に、DAT と bvFTD の理解が進むと、統合失調症や双極性障害などの障害の理解について楽観的な見方ができるようになるはずです。医師がこの進歩の臨床的影響を理解するには、精神科医とメンタルヘルスの専門家がこれらの進歩の根底にある神経科学を理解する必要があることを提案します。私たちはこの本を通してこのテーマを展開し続けます。
————————-
留意事項
臨床表現型 (つまり、疾患の兆候や症状) は、疾患に関与する神経ネットワークの性質を反映しています。
特定の神経ネットワークの機能障害にはさまざまな原因があります。認知症疾患の進歩を借りて、特定の臨床障害や病理が特定の脳システムを攻撃する可能性があるようです。特定の脳システムが攻撃に対して脆弱である理由はまだ明らかではありません。アクティビティが高く、エネルギー使用率が高いネットワークは、DAT などの病気に対して特に脆弱になる可能性があります。
特定の細胞および分子の原因についての知識がより具体的であればあるほど、薬理学的治療もより具体的にすることができます。
特定の治療法を常に最新の状態に保つためには、ニューラル ネットワーク、分子科学、臨床診断の基本原理を理解することが不可欠です。
————————-
推奨される読み物
Buckner, R.L.、Andrews-Hanna, J.R.、Schacter, D.L. (2008)。脳のデフォルトのネットワーク: 解剖学、機能、病気との関連性。ニューヨーク科学アカデミー年報、1124、1-38。
ケルテス、A. (2008)。前頭側頭型認知症:話題のレビュー。認知行動神経学、21、127-133。
Koob、GF、Volkow、ND (2010)。依存症の神経回路。神経精神薬理学レビュー、35、217-238。
モリス、J.C. (2006)。アルツハイマー病と軽度の認知障害。 J. C. Morris、J. E. Galvin、D. M. Holtzman (編)、認知症ハンドブック (第 2 版、191-208 ページ)。ニューヨーク:テイラーとフランシス。
モリス、J.C. (2006)。認知症最新情報 2006。J. C. Morris、J. E. Galvin、D. M. Holtzman (編)、認知症ハンドブック (第 2 版、475 ~ 503 ページ)。ニューヨーク:テイラーとフランシス。 J.L. プライス、W.C. ドレベッツ (2010)。気分障害の神経回路。神経精神薬理学レビュー、35、192-216。
ラビノビッチ、G.D. & ミラー、B.L. (2010)。前頭側頭葉変性症:疫学、病態生理学、診断と管理。 CNS ドラッグ、24、375-398。
Seeley, W.W.、Crawford, R.K.、Zhou, J.、Miller, B.L.、Greicius, M.D. (2009)。神経変性疾患は、大規模な人間の脳ネットワークを標的としています。ニューロン、62、42-52。
その他の参考文献
アメリカ精神医学会。 (1994年)。精神障害の診断および統計マニュアル (第 4 版)。ワシントン DC: アメリカ精神医学協会。
Buckner、R.L.、Sepulcre、J.、Talukdar、T.、Krienen、F.M.、Liu、H.、Hedden、T.、他。 (2009年)。固有の機能的接続性によって明らかにされる皮質ハブ: マッピング、安定性の評価、およびアルツハイマー病との関連。神経科学ジャーナル、29、1860-1873。 Buckner、R.L.、Snyder、A.Z.、Shannon、B.J.、LaRossa、G.、Sachs、R.、Fotenos、A.F.、他。 (2005)。アルツハイマー病の分子的、構造的および機能的特徴付け: デフォルト活性、アミロイド、および記憶の間の関係の証拠。神経科学ジャーナル、25、
7709-7717。
Craig-Schapiro, R.、Fagan, A.M.、および Holtzman, D.M. (2009)。アルツハイマー病のバイオマーカー。疾患の神経生物学、35、1288-1140。
ダマシオ、A. (1999)。何が起こったのかという感覚:意識の形成における身体と感情。カリフォルニア州サンディエゴ:ハーコート。
ダマシオ、H. (2005)。コンピューター画像による人間の脳の解剖学 (第 2 版)。ニューヨーク:オックスフォード大学出版局。
Duyckaerts、C.、Delatour、B.、および Potier。 M.-C. (2009年)。分類と基本的な病態
アルツハイマー病。 Acta Neuropathologica、118、5-36。
Fagan, A.M.、Roe, C.M.、Xiong, C.、Mintun, M.A.、Morris, J.C.、および Holtzman, D.M. (2007)。非認知症高齢者の認知機能低下の予測としての脳脊髄液タウ/β-アミロイド比。神経学アーカイブ、64、343-349。
ジョセフス、K.A. (2008)。前頭側頭型認知症と関連疾患: 謎を解読する。神経学年代記、64、4-14。
パロップ、J.J.、ムッケ、L. (2010)。アルツハイマー病におけるアミロイドα誘発性神経機能障害: シナプスから神経ネットワークへ。 Nature Neuroscience、13、812-818。 Peterson, B.S.、Warner, V.、Bansal, R.、Zhu, H.、Hao, X.、Liu, J.、他。 (2009年)。大うつ病の家族性リスクが高い人の皮質の薄化。米国科学アカデミー紀要(米国)、106、6273-6278。
ポスト、R.M. (2007)。感情エピソードの再発、周期性、耐性現象のモデルとしてのキンドリングと感作。神経科学と生物行動のレビュー、31、858-873。 A.J. ラッシュ (2007)。 STAR*D: 私たちは何を学びましたか?アメリカ精神医学ジャーナル、164、
201-204。
Sheline, Y.I.、Raichle, M.E.、Snyder, A.Z.、Morris, J.C.、Head, D.、Wang, S. 他(2010年)。アミロイド斑は、認知的に正常な高齢者の安静状態のデフォルトモードのネットワーク接続を破壊します。生物学的精神医学、67、584-587。
Snider, B.J.、Fagan, A.M.、Roe, C.、Shah, A.R.、Grant, E.A.、Xiong, C. 他(2009年)。極軽度アルツハイマー型認知症における脳脊髄液バイオマーカーと認知機能低下率。神経学アーカイブ、66、638-645。
Sperling, R.A.、Laviolette, P.S.、O’Keefe, K.、O’Brien, J.、Rentz, D.M.、Pihlajamaki, M.、他。 (2009年)。アミロイド沈着は、認知症のない高齢者のデフォルトネットワーク機能の障害と関連しています。ニューロン 63、178-188。

