7 アルツハイマー病: 定義と診断
-------------
重要な概念
・アルツハイマー病(AD)は認知症の最も一般的な形態であり、全症例の約60%から70%を占め、400万人から500万人のアメリカ人が苦しんでいます。
・現在の研究では、アルツハイマー病の潜在的な原因として次の 2 つの要因が指摘されています: ベータアミロイドタンパク質の神経外沈着とタウタンパク質の神経内不安定化。
・アルツハイマー病のほとんどの症例は 65 歳以降に始まり、既知の遺伝的原因とは関連していません。主な危険因子には、加齢、女性の性別と閉経、脳損傷、およびアポリポタンパク質 E ε4 (APOE ε4) 遺伝子対立遺伝子の存在が含まれます。
・アルツハイマー病の診断は患者の病歴と神経心理学的検査に依存します。バイオマーカーと遺伝子検査は、診断の確実性をわずかに高めるだけである可能性があります。
-------------
認知症の医学的概念は何世紀にもわたって存在していましたが、最も一般的な形態の認知症に関する現代の知識が始まったのは 100 年ちょっと前です。 1901 年後半、ドイツの 51 歳の女性が、数カ月間にわたって進行性の記憶障害と、怒りの爆発や偏執的な観念などの行動障害を患い、精神病院に運ばれた。次の 4 年間、彼女は精神科医によって追跡され、彼女の認知障害が悪化するという下降傾向を示しました。精神障害。そして最終的には死ぬ前の植物状態になります。彼女の死後、彼女の長い経過を通じて正確な診断を下すことができなかった精神科医は、ついに実際の脳組織を観察することができた。その結果は驚くべきものでした。脳細胞は、密集した茶色に染まった物質の塊によって消されており、細胞自体は他の細胞構成要素を破壊したと思われる黒い線維のもつれによって覆われていました。この献身的で妥協のない医師、Dr.アロイス・アルツハイマーは、現在臨床医がプラークやタングルとして知っているもの、つまり彼が最初に書き、今日彼の名前が付けられたこの病気の病理学的特徴に注目していました。
現時点では、AD は認知症の最も一般的な形態として認識されており、単独または部分的に、全症例の 60% ~ 70% を占めています。米国では400万人から500万人をわずかに超える人がこの病気に苦しんでいます。 65 歳以降、有病率は 5 年ごとに 2 倍になり、65 歳でアルツハイマー病を患う人は 5% 未満ですが、85 歳以上の人のほぼ 50% がアルツハイマー病に罹患しています。この最も脆弱な年齢層は、人口の中で最も急速に増加している層の一つでもあるため、病気の予防が大幅に進歩しない限り、2030年までに米国で少なくとも1,000万人がアルツハイマー病に悩まされることになる。アルツハイマー病が米国における死亡原因の第 4 位であるという認識は、身の引き締まる思いです。当然のことながら、社会的、経済的負担は驚異的です。 AD が米国経済にもたらす年間コストは 1,000 億ドルに達すると推定されており、AD は癌と心臓病に次いで 3 番目に高価な病気となっています。軽度アルツハイマー病の患者一人当たりの年間介護費用は平均 18,000 ドル以上で、この数字は病気が重篤な段階では 2 倍になります。典型的な 8 ~ 10 年の病気の経過における個人の支出総額は、20 万ドルに達する場合があります。
これらの数字とは別に、AD の最も恐ろしい側面は、進行性で不治の疾患であるというまさにその性質にあります。約 10 年前までは、AD も比較的治療が困難でした。これが、多くの個人やその家族が初期段階で示す反応、つまり病気の否認、個人の欠点の隠蔽、または経過に対する運命論の原因となっている可能性があります。おそらくこれらの反応は、米国でアルツハイマー病患者のうち臨床的にアルツハイマー病と診断されているのは約 60% だけであり、特別な治療を受けている人はさらに少ないという事実も説明しているでしょう。これは、早期診断には多くの明白な利点が存在するという事実にもかかわらず (第 1 章を参照)、AD の症状に対する効果的な薬物治療が 15 年近くも市販されているにもかかわらず (第 8 章を参照) 当てはまります。
*アルツハイマー病とは何ですか?
AD は、ゆっくりとした進行性の認知機能の喪失を特徴とする皮質性認知症であり、通常 8 ~ 12 年間 (範囲は 5 ~ 20 年) 続き、最終的には植物状態になり、その後死に至ります。 AD の臨床徴候は通常、晩年に現れますが、病理学的特徴はずっと早くから始まる場合もあります。アルツハイマー病は、発症年齢(早期または晩発)および遺伝パターンの有無(家族性か散発性)によって分類されています。若年性アルツハイマー病は、アルツハイマー病の全症例のわずか 5% ~ 10% を占め、65 歳未満で発症し、通常は比較的急速に経過します。逆に、遅発性アルツハイマー病は残りの 90% ~ 95% を占め、65 歳以降に発症します。家族性アルツハイマー病の既知の症例はすべて早期に発症しており、特定の染色体に原因が追跡されています。突然変異。散発性アルツハイマー病は発症年齢が遅くなる傾向があり、ある程度の遺伝的感受性と関連しています。さらなる研究により、最終的には散発性アルツハイマー病の遺伝パターンが特定されるかもしれないが、これらを認識することはより困難であり、遺伝的要因と環境的要因の間の相互作用を伴うことは確実である。遺伝的要因は、アルツハイマー病の危険因子に関するセクションでさらに詳しく検討されています。
*診断基準
現在、アルツハイマー病には次の 2 つの診断基準が最も一般的に使用されています。精神障害の診断と統計マニュアル、第 4 版、テキスト改訂 (DSM-IV-TR) 基準と、国立神経障害・コミュニケーション障害・脳卒中研究所による基準です。アルツハイマー病および関連障害協会 (NINDS-ADRDA) の基準。これらをそれぞれ表 7.1 および 7.2 に示します。両方の基準セットに存在する AD の重要な側面は、認知障害の進行性および全体的な性質です。本書が概説しているように、他の主要な認知症の形態は、より特定の領域の障害が関与する傾向があり、一般に、より急速な経過をたどるか、予測不可能な経過をたどります。 NINDS-ADRDA 基準は、診断の確率を考慮する点で独特です。
*アルツハイマー病の経過
AD は通常、頻繁な物忘れ、複雑な日常業務の困難 (例: 小切手帳の残高照合、イベントやプロジェクトの計画)、単語の検索の困難、および注意力の低下など、記憶と見当識の微妙な変化から始まります。人や場所の認識。この初期段階は数年間続く場合があり、薬の副作用によるより軽度の認知障害状態、医学的または精神的な病気、または加齢に伴う記憶障害や軽度認知障害などの症候群(第 1 章および第 6 章を参照)と区別できない場合もあります。
-------------
表7.1.アルツハイマー型認知症の基準、精神障害の診断と統計マニュアル、第 4 版、改訂版より
A. 以下によって現れる複数の認知障害の発症。
記憶障害と、失語症、失行症、失認症、実行機能障害のうちの 1 つ以上。
B. 認知障害は以前からの低下を表している
機能が低下し、社会生活にまたは職業上の機能に重大な障害を引き起こす
C. このコースは徐々に始まり、認知機能の低下が継続することを特徴としています。
D. 認知障害は、記憶と認知の進行性障害を引き起こす他の中枢神経系、全身性、または物質誘発性の状態によるものではありません。
E. 障害は別の要因ではうまく説明されない
精神障害。
米国精神医学会の精神障害の診断と統計マニュアル、第 4 版、本文改訂版より。ワシントン D.C.: アメリカ精神医学会、2000 年、許可を得て。
-------------
アルツハイマー病が進行するにつれて、認知障害は悪化し、より広範囲になり、不安、うつ病、無関心、興奮、精神病などの併存精神障害の発生率が増加します。個人の機能は、自立した生活が非常に危険になるまで低下し、個人は介護者や体系化された生活環境に頼らなければなりません。病気になってから 8 ~ 10 年までに、初期の記憶障害、言語障害 (失語症)、運動能力 (失行症)、認識障害 (失認) が重度の状態に進行し、個人は完全に介護者に依存するようになります。
アルツハイマー病の末期段階では、罹患者は通常、支離滅裂か完全に無言になります。彼らは周囲や近親者を認識することができません。そして最終的には、歩くことも、食事をすることも、簡単な活動に参加することさえできなくなります。行動上の問題は徐々に減り始めるかもしれませんが、機能の崩壊と、摂食不良、栄養失調、転倒による怪我、危険な行動の発生率の増加によって上書きされます。
運動不足によって引き起こされる褥瘡。死亡はアルツハイマー病自体の病理学的影響によって生じるのではなく、関連する感染、脱水、損傷、または他の医学的疾患によって引き起こされます。
ーーーーーーーーーーーーーーー
表 7.2.国立神経伝達障害研究所および脳卒中アルツハイマー病および関連障害協会による、アルツハイマー病の確定的、可能性の高い、および可能性に関する基準


-------------
-------------
臨床ビネット
ソーブル夫人は、軽度のうつ病と片頭痛の病歴を持つ、75 歳の元不動産ブローカーでした。娘は、最近の電話での会話の内容を覚えていないなど、母親の軽い物忘れに気づき始めました。彼女はまた、母親が時々イライラしやすくなり、友人に対してあまり社交的ではなくなったことにも気づきました。彼女はこれがうつ病の増悪のせいだと考え、母親に精神科医の診察を受けるよう勧めた。バーガン医師はソーブル夫人が落ち込んでいるように見えることに同意し、以前は効果があった選択的セロトニン再取り込み阻害剤の抗うつ薬の投与を再開した。ソーブルさんの気分はいくらか改善したものの、運転中に頻繁に見当識障害を起こし、物忘れが続いた。彼女は帰宅するための援助を得るために何度も娘に電話しなければなりませんでした。これらの変化に最初に気づいてから 12 か月後、ソーブル夫人の娘は精密検査を受けるために彼女を医師に連れて行きましたが、明らかな検査は行われませんでした。ソーブルさんは認知症クリニックに紹介され、そこでの評価によりおそらく AD の診断が示唆されました。
翌年、症状は進行し、ソーブル夫人はもはや安全に運転できなくなり、小切手帳の残高を調整したり、小さな家を管理したりすることがますますできなくなった。病気になって 3 年目に、ソーブルさんは自立生活施設に移りましたが、薬を安全に管理できずアパートを維持できないため、3 か月以内に退去を求められました。彼女の娘は、彼女を介護付き生活施設に移しました。そこでは、追加の構造と毎日 5 時間の介助により、彼女はある程度の自立を維持することができました。しかし、その後 2 年間、ソーブル夫人の記憶力は低下し続け、建物内で自分の位置を特定したり、スタッフを認識したりする能力も低下しました。彼女は自分の身の回りのすべてを娘に任せるようになりました。彼女はまた、側近たちが自分から物を盗もうとしているのではないかという偏執的な懸念を示し、二度にわたってアパートに立てこもった。彼女の精神科医は、彼女を落ち着かせ、偏執的な妄想を治療するために、抗うつ薬を増量し、抗精神病薬を追加しました。
病気になって6年目、ソーブル夫人はアパートで転倒し、股関節を骨折した。彼女は人工股関節置換術後にせん妄を患い、精神状態がいくらか改善した後、リハビリのために熟練した介護施設に入院しました。ソーブルさんは、顕著な認知障害とスタッフとの戦闘期間があったため、介護施設には戻らず、長期介護施設の認知症病棟に移送された。病気になって7年目になるまでに、ソーブル夫人は娘しか認識できなかった。彼女は言葉を見つけるのが難しいため、うまくコミュニケーションをとることができませんでした。 8 年目になると、彼女は衛生管理と着替えについて完全にスタッフに依存するようになりましたが、促されればまだ自分で食事をすることができました。一年を通して、彼女は何度か転倒し、車椅子生活になった。 9年目には、ソーブル夫人は一日のほとんどを車椅子に座るかベッドに横になって過ごし、口頭でのコミュニケーションは最小限に抑えた。彼女はもはや自分の娘を認識できなかった。彼女は体重が減少し始め、食欲不振と軽度の嚥下障害により栄養失調になりました。 10年目、ソブル夫人は誤嚥性肺炎を発症し、食事をとらなくなった。 2週間の植物状態の後、彼女は死亡した。
-------------
ソブル夫人の病気の経過は、記憶機能障害から始まり、時間の経過とともに複数の認知スキルの喪失を伴うADのゆっくりとした進行性の経過を示している。行動と性格の変化。そして基本的な身体機能が失われ、最終的には死に至ります。
**アルツハイマー病の物語
*概要
加齢に伴い、すべての脳はアルツハイマー病患者の脳を麻痺させるのと同じ病理学的変化を示します。ニューロンの喪失とその後の脳組織の縮小または萎縮、脳室の拡大、および神経炎斑や神経原線維変化として知られる細胞破片の病理学的集合です 。正常な脳とアルツハイマー病の脳の両方におけるこの神経損傷の加齢に伴う原因の 1 つは、酸化ストレスである可能性があります。酸化ストレスでは、フリーラジカルと呼ばれる活性酸素種の蓄積が DNA やその他の細胞成分に損傷を与えます。しかし、アルツハイマー病では、このプロセスの劇的な加速と増大が起こり、脳の構造と機能がゆっくりと着実に侵食され、これまでに説明されている臨床症状が引き起こされます。現在理解されている AD の病理学的プロセス全体の概略図を図 7.1 に示します。
※アミロイドとタウ
現在、ほとんどの科学者は、アルツハイマー病の物語は脳内のアミロイドタンパク質の異常な蓄積から始まると信じています。アミロイドは、通常、脳全体のニューロンの細胞膜に見られるアミロイド前駆体タンパク質(APP)と呼ばれる、より大きなタンパク質の一部に由来します。 APP の正確な役割はまだ決定されていません。 APP は通常、α-セクレターゼと呼ばれるプロテアーゼ酵素によって代謝されます。しかし、ADでは、APPの代謝は、APPを切断する他の2つの酵素、β-セクレターゼおよびγ-セクレターゼ(それぞれ、β部位またはy部位APP切断酵素、またはBACEおよびGACEとも呼ばれる)によって変化する。 40 または 42 アミノ酸のタンパク質断片を生成します。この異常な形態のアミロイドはβ-アミロイドと呼ばれます(以下、本文中ではAβと表記します)。 40 アミノ酸のバリアント (Aβ40) はより一般的ですが、42 アミノ酸のバリアント (Aβ42) は、特に初期段階の AD ではより病的であるように見えます。 AB フラグメントの形成にセクレターゼ酵素の一方または両方が必要かどうかは不明です。しかし、Aβ が形成されると、不溶性シート (B プリーツ シートと呼ばれる) に蓄積する傾向があり、脳内のニューロン間のスペースや小さな血管に蓄積されます。
-------------
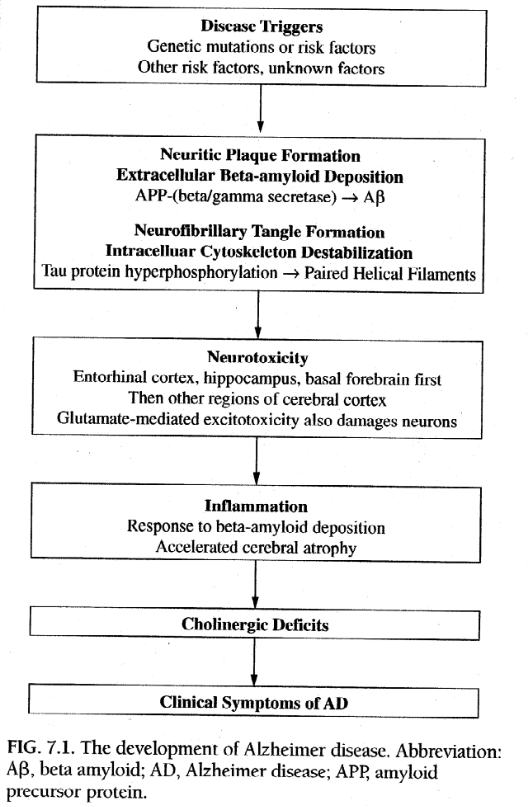
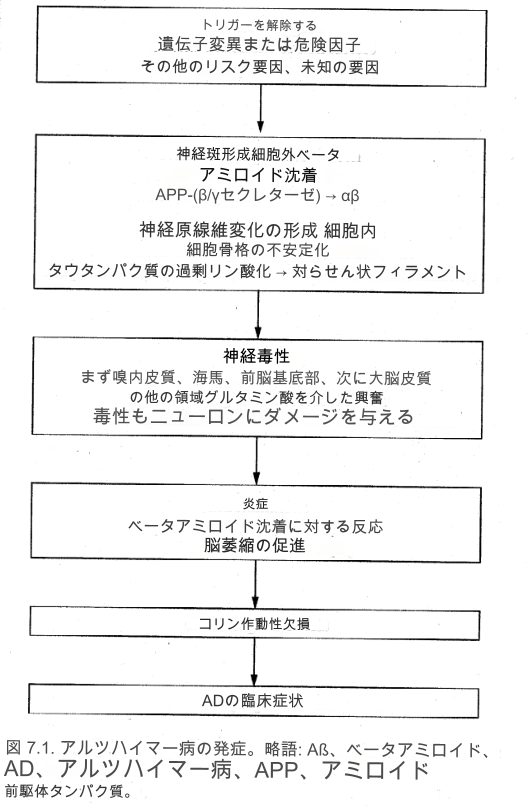
図7.1.アルツハイマー病の発症。略語: Aβ、ベータアミロイド。アルツハイマー病、アルツハイマー病。 APP、アミロイド前駆体タンパク質。
-------------
不溶性 Aβ 沈着には 2 つの点で問題があります。まず、それらは神経毒性があり、周囲のニューロンの死滅を引き起こします。第二に、Aβ の沈着は脳内で異物として作用し、さらなる神経損傷と死を引き起こす炎症反応を誘発します。活性化された白血球とミクログリア細胞は炎症性の化学メディエーターを放出し始め、次に周囲の星状膠細胞を活性化します。病理学的結果は、損傷されたまたは死んだ軸索、樹状突起、およびグリア細胞(ミクログリアおよびアストロサイト)に囲まれたアミロイドタンパク質シートの密なコアからなる、悪名高い老人斑または老人斑である病変またはプラークである。このプロセス全体が AD を引き起こすという考えは、アミロイド カスケード仮説と呼ばれます。信じられないほどの量の研究がこのプロセスに関係していると考えられていますが、Aβ 沈着が AD の主な原因であるのか、それとも他の未発見の原因の副産物であるのかはまだ明らかではありません。
プラークの形成と同時に、神経細胞体内の並行プロセスが細胞の主要な支持構造(または細胞骨格)と微小管で構成される輸送システムを破壊することで大混乱を引き起こします。微小管構造を安定化させるタウと呼ばれるタンパク質は過剰リン酸化され、その鎖が互いに巻きつき、いわゆる対らせんフィラメントを形成する。これらのフィラメントは微小管システムを安定化させることができません。代わりに、それらは凝集して神経原線維変化と呼ばれる塊になり始めます。内部の構造的サポートが剥奪された細胞内通信システムが正常に機能しなくなると、細胞体は正常に機能できなくなります。
プラークおよびもつれが増殖するにつれて、ニューロンおよびそれらを支持するグリア細胞の進行性の喪失が起こり、アルツハイマー病の脳を肉眼的に検査すると、溝と心室が拡大した顕著な皮質萎縮が明らかになります。脳組織を詳しく検査すると、アルツハイマー病の経過中に次の主要な脳領域、すなわち嗅内皮質、海馬、前脳基底部、そして最終的には皮質全般が連続して影響を受けることが示される。側頭葉内で互いに隣接して位置する嗅内皮質と海馬はどちらも記憶形成に重要です。機能的スキャンにより、これらの構造の劣化がアルツハイマー病の初期指標であることが判明しました。これらの構造におけるニューロンの喪失は、おそらくアルツハイマー病における短期記憶障害の初期症状の原因であると考えられます。
前脳基底部、特にメイネルト基底核には、神経伝達物質アセチルコリンを介してメッセージを生成し、脳全体に伝達する多数の細胞体が含まれています。コリン作動性仮説は、その結果生じるアセチルコリンの欠乏、ひいてはコリン作動性機能の欠乏がアルツハイマー病の臨床症状の原因であることを示唆しています。この仮説を裏付ける実験モデルの 1 つは、抗コリン薬(スコポラミンなど)の静脈内投与がアルツハイマー病の症状と同様の記憶および認知機能の障害を引き起こす可能性があることを示しています。他の研究では、体内の抗コリン薬の負荷と症状が関連付けられています。せん妄のリスクが増加します。
アルツハイマー病における神経損傷は、記憶形成のための重要な神経伝達物質であるグルタミン酸のシナプスへの過剰放出によってもたらされ、部分的にはAβによって引き起こされるとも考えられている。興奮毒性として知られるこのプロセスは、細胞への過剰なカルシウム流入、および Aβ 産生とタウ過剰リン酸化の両方の増加によってニューロン損傷を引き起こします。
病気が進行するにつれて、側頭葉皮質、頭頂葉皮質、後頭葉皮質、および前頭葉皮質における神経細胞の喪失がより顕著になります。これらの変化は、失語症、失行症、失認症、実行機能障害などの疾患の基本的な特徴を説明します。さらに、扁桃体、青斑核、縫線核など、行動、感情表現、神経栄養機能(睡眠、食事、モチベーションなど)を調節する脳領域への損傷が発生します。後の 2 つの核は、神経伝達物質であるノルエピネフリンとセロトニンの合成と放出をそれぞれ制御します。脳内の化学物質の一方または両方の異常な変化が、アルツハイマー病におけるうつ病や行動上の問題の罹患率の高さの原因となっている可能性があります。
*アルツハイマー病を発症するリスクがあるのは誰ですか?
AD には多数の危険因子が存在しますが、その多くは今説明した病理学的スキームと結びついています。リスク要因を表 7.3 および 7.4 にまとめます。
*年齢
有病率は65歳以降5年ごとに2倍になり、85歳以上の地域社会の40~50%がアルツハイマー病に罹患していることを考えると、高齢が最も劇的なリスクとなる。
-------------
表7.3.アルツハイマー病の遺伝的危険因子
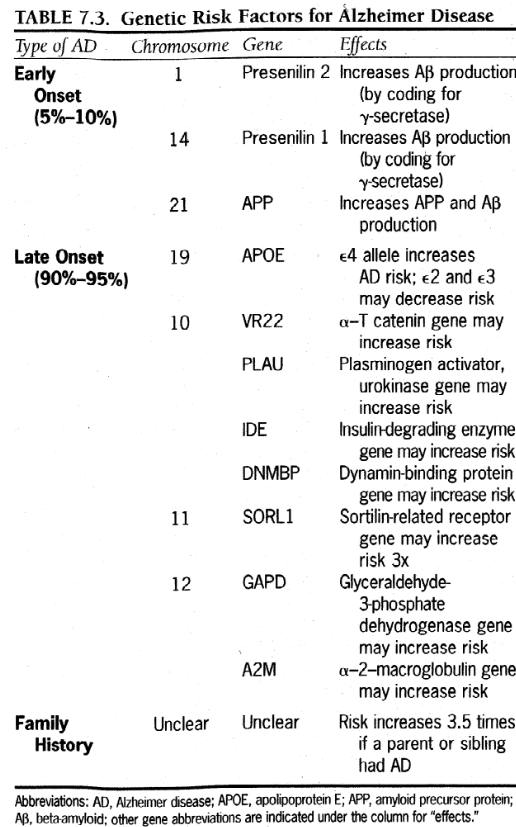
略語;AD、アルツハイマー病。 APOE、アポリポタンパク質 E; APP、アミロイド前駆体タンパク質。 Aβ、ベータアミロイド。他の遺伝子の略語は「効果」の列の下に示されています。
ーーーーーーーーーーーーーーー
AD の要因。前述したように、フリーラジカルによって引き起こされる酸化ストレスは加齢に関連する要素の 1 つですが、これが唯一の要素ではなく、最も影響力のある要素でもありません。
*遺伝子
遺伝的危険因子はアルツハイマー病の最も広く研究されている側面の一部を構成しており、これらは原因の探索において最も有益であることが証明されています。親や兄弟などの一親等の親戚にアルツハイマー病がいると、アルツハイマー病になるリスクが約 3.5 倍増加します。兄弟姉妹が罹患した場合、リスクは最も大きくなり、罹患した親族の数が増えるにつれて増加します。同一遺伝子(つまり一卵性双生児)の AD の一致率は 50% です。
-------------

-------------
すべての家族性サブタイプを含む若年性アルツハイマー病は、染色体 1、14、および 21 上の遺伝子変異が原因であることが追跡されており、そのすべてが Aβ の産生の増加に関連しています。 3 つの場合すべての遺伝形式は常染色体優性であり、人が影響を受けるためには親からの遺伝子のコピーが 1 つだけ必要であることを意味します。科学者らは、染色体 14 上のプレセニリン 1 遺伝子と染色体 1 上のプレセニリン 2 遺伝子が、そもそも Aβ の生成に関与する重要な酵素の 1 つである γ セクレターゼを実際にコードしている可能性があると提案しています(β セクレターゼは染色体上でコードされている可能性があります)。 11)。早期発症症例の約 40% は 14 番染色体に関連しているが、1 番染色体に関連する症例は、ヴォルガ川渓谷から米国へのドイツ移民の子孫である少数の家族グループで発生します。もう 1 つの早期発症遺伝子変異は、APP をコードしている可能性のある 21 番染色体上の遺伝子に遡ることが判明しています。これは、21 番染色体のコピーを 3 つ持つダウン症候群 (21 トリソミー) を持つ人が、40 代までに避けられない AD 病理の発症 (必ずしもその臨床症状ではないが) に直面する理由をよく説明するかもしれません。
散発性疾患を含む遅発性 AD または LOAD は、早発性 AD よりも複雑な遺伝子像を持っています。 LOAD は、病気を引き起こす可能性のある特定の遺伝子変異と関連しているのではなく、病気の発症のしやすさに影響を与える多くの遺伝的要因と関連しています。最も重要な要因は、染色体 19 上のアポリポタンパク質 E または APOE 遺伝子変異体です。APOE は、髄鞘形成と神経膜修復を助ける脂質代謝に関与しています。それはニューロンとグリア細胞の両方に見られ、老人斑では増加した量で見られます。 APOE のアイソフォームは、α2、α3、ε4 と名付けられた 3 つの対立遺伝子によってコードされており、そのうちα3 が最も一般的です。誰もがそれぞれの親から 1 つの対立遺伝子を受け継ぎ、次の 6 つの可能な遺伝子型を生成します: ?2/ ?2、?2/ ?3、?2/ e4、?3/ ?3、?3/ ε4、および ε4/ ε4。 ?3/ ?3 は最も一般的な遺伝子型です。それは人口の60%に見られます。 APOE β2 および APOE β3 対立遺伝子は実際に AD に対して保護的である可能性がありますが、APOE ε4 対立遺伝子は発症年齢が若く、経過が悪化するため、この疾患のリスクがはるかに高くなります。
全体として、遅発性アルツハイマー病の症例の 50% は e4 対立遺伝子を持っています。コピーが 1 つある場合(ヘテロ接合体)、アルツハイマー病を発症するリスクは 3 倍増加しますが、コピーが 2 つある場合(ホモ接合体)は、年齢に応じてリスクが 5 ~ 15 倍増加します。 80歳までに、APOE ε4 ホモ接合体の90%がADを発症するが、APOE ε4 ヘテロ接合体のほぼ50%、APOE ε4 対立遺伝子を持たない個人の20%がADを発症する。 ε4 対立遺伝子を持つ女性は、アルツハイマー病を発症するリスクがはるかに高くなります。同様に、APOE ε4 対立遺伝子と脳血管疾患の両方を有する人は、アルツハイマー病の罹患率がはるかに高くなります。しかし、APOE ε4 対立遺伝子を両方持っているとしても、その人が AD を発症するという保証はなく、これは他の要因が関与していることを明確に示しています。
LOAD に対する他の遺伝的感受性因子は、染色体 10、11、および 12 で見つかっています。これらは表 7.3 にリストされており、ニューロン内の APP の分布を制御する可能性がある染色体 11 上の最近同定された SORLI 遺伝子が含まれており、これは関連していると考えられています。一部の選択された集団では LOAD のリスクが 3 倍増加します。広範な研究にもかかわらず、これらの要因のどれも、APOE ε4 遺伝子で見つかった量の経験的裏付けを蓄積していません。
*性別
女性は男性よりも長生きであるという事実を考慮したとしても、アルツハイマー病を発症するリスクがより高くなります。この違いは、閉経後のエストロゲンの喪失によるものである可能性があり、神経の成長と発達の促進、抗炎症作用と抗酸化作用、脳血流の増加、中枢機能の改善による記憶力の向上など、脳のコリン作動性機能に対するエストロゲンの利点が示唆されています。しかしながら、アルツハイマー病におけるエストロゲンの役割については依然として議論の余地があり、エストロゲンとアルツハイマー病のリスク増加との潜在的な関連性については第 8 章で議論されています。
*脳の大きさと知能
いくつかの研究では、頭囲と脳の大きさが小さく、知能が低く、人生の早い段階で正式な教育を受けていない人は、特に APOE ε4 対立遺伝子と組み合わせた場合にアルツハイマー病のリスクが増加することが示唆されています。反対に、頭囲と脳の大きさが大きく、知能が高く、人生の早い段階で高等教育を受けている人は、アルツハイマー病のリスクが低下したり、発症が遅れたりする可能性があります。これはおそらく、これらの要因がより大きな保護的認知予備力を与えているためと考えられます。知性と教育の役割に関する潜在的な証拠が修道女研究で発見されている。修道女研究は、定期的な検査に参加し、死後脳を提供することに同意した修道女グループを対象とした進行中のアルツハイマー病に関する縦断的研究である。研究者らは、修道女たちが成人初期に修道会に申請した際に書いたエッセイを検討することによって、言語能力の低下(文法の複雑さの程度と文章のアイデアの密度によって測定)がアルツハイマー病の発症率の上昇と関連していることを発見した。この研究は、言語能力の低下が早期の前臨床病態であるかどうかという疑問を提起している。後にアルツハイマー病を発症した人々の脳の論理的変化が、その知性と学力を微妙に制限したのか、あるいは知能が低い人や学歴が低い人は認知予備力が小さいのか、あるいはアルツハイマー病のリスクを高める他の何らかの要因を持っていたのか、などである。
*脳の損傷
外傷性脳損傷は、たとえ人生の早い段階であっても、損傷の重症度に応じてアルツハイマー病のリスクを2~4倍増加させる可能性があります。脳損傷が Aβ の生成を引き起こす可能性があると考えられています。実際、いくつかの研究では、過去に脳外傷を受けた領域で Aβ が増加していることが判明しています。
*ライフスタイル
身体運動を伴うアクティブなライフスタイルは、アルツハイマー病のリスクを軽減する可能性があります。たとえば、ある研究では、少なくとも週に3回早歩きをしている人ではアルツハイマー病のリスクが3分の1低いことがわかりました。一つの説明として、運動は、肥満、高血圧、糖尿病(DM)、高コレステロール血症、脳血管疾患、心血管疾患など、アルツハイマー病のリスクを高める原因となる病状のリスクを軽減したり、その影響を和らげたりする可能性があります。積極的な社会的および精神的刺激は、おそらく脳の活動を増加させ、より大きな認知予備力を発達させることによって、アルツハイマー病のリスクを軽減することもわかっています。 75歳以上の1200人を対象としたスウェーデンの研究では、一人暮らし、友達がいない、子供との関係が悪い人は認知症を発症する可能性が60%高いことが示された。よりアクティブなライフスタイルは、アルツハイマー病のリスクを高める可能性のあるストレスとうつ病の両方を軽減するのに役立つ可能性があります。
*医学的および精神疾患
DM、高血圧、肥満、脳血管疾患、心血管疾患、脳卒中、高コレステロール血症など、多くの医学的疾患を患っている人はアルツハイマー病の罹患率が高くなります。ある研究では、DM患者はADのリスクが65%増加しました。コレステロールとホモシステインの両方のレベルが上昇すると、おそらく Aβ の産生が増加するため、アルツハイマー病のリスクが増加します。アルツハイマー病の増加は、アルコール乱用、ストレス、大うつ病とも関連しています。持続的に上昇したコルチゾールレベルは海馬のニューロンに有毒である可能性があるため、慢性的なストレスやうつ病を抱えている人はアルツハイマー病の発症率が高いと仮定されています。タバコ製品の使用はさまざまなリスクをもたらす可能性があります。一方で、ニコチンの使用は(コリン作動性機能に対するプラスの効果を考慮すると)実際にアルツハイマー病のリスクを軽減することがいくつかの研究で判明しています。一方、喫煙はアテローム性動脈硬化のリスクを高め、ひいてはアルツハイマー病のリスクも高めます。結局のところ、タバコ使用による健康リスクは、アルツハイマー病のリスク軽減という点での潜在的な利益を確実に上回っています。
第 6 章で概説したように、軽度認知障害 (MCI)、特に健忘サブタイプの存在は AD のリスクを大幅に増加させ、年間 12% ~ 18% の罹患者が MCI から AD に移行します。
*食事
以下の食事要因がアルツハイマー病のリスクを軽減する可能性があるという証拠が増えています。オメガ3脂肪酸。魚油が豊富な食事(ある研究では、週に1食分でリスクが60%減少しました)。果物または野菜ジュースを毎日少なくとも 3 回摂取する(日系アメリカ人を対象としたある研究ではリスクが 75% 減少)。抗酸化物質が豊富な食品(柑橘類、ベリー、ブロッコリー、ニンジン、トマトなど)。ビタミンCおよびE、葉酸、ビタミンB12、ナイアシン。地中海食は、魚やオリーブオイルからの健康的な脂肪が豊富で、果物や野菜がたくさん含まれています。葉酸とビタミンB12はどちらも、アルツハイマー病の危険因子であるホモシステインを低下させるのに役立ちます。ある研究では、葉酸を豊富に含む食事でリスクが50%減少することがわかりました。明らかに、これらの発見には重複があり、全体として、高脂肪、高カロリーの食事はリスクを高める一方、魚、果物、野菜が豊富な低脂肪、低カロリーの食事はリスクを防ぐ効果があることを示しています。 1日グラス1杯のワインやビール1本といった軽度のアルコール摂取は、一部の人にとっては予防効果がある可能性がありますが、大量のアルコール摂取はリスクを高めます。これらの食事の利点の多くが及ぼす影響は、その人の全体的なライフスタイルや、APOE ステータスを含む遺伝子構造によって異なります。
*診断
特定の認知症患者について何も知らなくても、臨床医は疫学研究を通じて、全症例の 60% ~ 70% に AD が関与していることを知っています。言い換えれば、たとえアルツハイマー病の診断を推測したとしても、それは正しい可能性が高いのです。しかし、現時点では、100% の確実性で AD の診断を行う唯一の方法は、脳組織にプラークやもつれが存在するかどうかを検査することです。明らかに、これは大多数の患者にとって現実的なアプローチではありません。ただし、AD の診断は決して当てずっぽうではなく、90% ~ 95% の精度で確実な診断を下すことが可能です。研究は、この確実性をさらに高める画期的な進歩を迎えようとしています。 AD の診断精密検査には、第 1 章から第 5 章で概説したすべてのコンポーネントが含まれます。この章では、別のタイプの認知症ではなくアルツハイマー病を示唆するいくつかの特定の発見に焦点を当てます。
-------------
ヒント
患者や介護者は多くの場合、当然のことながら、診断の確実性をできるだけ高くしたいと考えています。 「彼または彼女はアルツハイマー病を患っていますか?」とよく尋ねられるでしょう。家族の質問に明確に答えることは重要ですが、性急に判断しないでください。多くの人は AD を患っているように見えますが、長期にわたる観察は診断を裏付けません。利用可能な情報がすべて揃っていない状態で、このような暗い経過をたどる診断を提供することは望ましくありません。逆に、アルツハイマー病の可能性を隠したり、患者や家族に誤った希望を与えたりしないでください。ただし、AD の診断が 100% 確実に下されるまでは、常に経験に基づいた推測をしなければならない状況になります。
-------------
*歴史と検査
認知症の病歴が最初の診断の手がかりとなります。記憶障害から始まり失語症、失行症、失認症、実行機能障害が徐々に進行する認知機能の低下などは、ほとんどの場合アルツハイマー病を指します。持続的な局所障害または顕著な改善が観察された場合、その症例はほぼ確実に AD ではありません。脳卒中の病歴など、アルツハイマー病と一致する症状が血管危険因子と重なる場合、診断はより困難になる可能性があります。またはパーキンソン病などの認知障害を引き起こすことが知られている他の疾患。場合によっては、早期の AD は、顕著な性格変化、行動障害、うつ病、または精神病と関連しています (詳細については、第 13 章から第 15 章を参照)。神経学的検査でははっきりしないことが多く、診断を確定することはできません。 AD の初期および中期では、特徴的な所見は存在しませんが、AD の後期では、不安定な歩行、構音障害および嚥下障害、ミオクローヌスを伴う運動機能障害の増加が伴う場合があります。
*神経画像診断
AD は多くの神経放射線検査所見と関連しています。構造コンピュータ断層撮影 (CT) および磁気共鳴画像法 (MRI) では、通常、海馬で特に顕著な進行性脳萎縮が明らかになります。可能であれば、診断スキャンでは海馬を強調表示して拡大し、萎縮の程度を判断する必要があります。アルツハイマー病では、MRI で視覚化できる脳卒中、ラクナ梗塞、白質高信号などの血管損傷の証拠も一般的です。これらの所見は、AD、血管性認知症、および混合状態の間の鑑別診断を複雑にする役割を果たします。
機能的陽電子放射断層撮影法 (PET) と単一光子放射断層撮影法 (SPECT) は、AD における非対称な頭頂葉と側頭葉の代謝低下の一貫したパターンを実証しました。これらの所見にもかかわらず、現在の臨床ガイドラインでは、コストが高く、明確な診断上の有用性が欠如しているため、PET または SPECT スキャンの日常的な使用を推奨していません。しかし、機能スキャンの進歩により、将来的には機能スキャンが好ましい診断方法となる可能性があります。最近の研究では、臨床医がアルツハイマー病の診断と段階付け、および薬剤の効果の追跡を行うために、脳内のプラークともつれの負荷を視覚化および定量化できるようにする新しい化合物が単離されました。ピッツバーグ大学で開発され、ピッツバーグ コンパウンド B または PIB として知られる化合物は、Aβ に結合し、PET スキャンで可視化できます。 18F-FDDNP として知られる別の PET イメージング化合物は UCLA で開発され、プラークおよびもつれ内の Aβ およびタウタンパク質の両方に結合することができます。ある研究では、フルオロデオキシグルコース PET スキャンと組み合わせた FDDNP スキャンにより、AD 患者と MCI 患者を 98% の精度で区別することができました。このようなイメージング化合物の使用により、近い将来、医師が AD を診断するために仮想脳生検を実施できるようになる可能性があります。
*神経心理検査
アルツハイマー病は早期に海馬に影響を与えるため、障害の最初の兆候には、記憶が長期記憶にエンコードされることが含まれます。結果として、最も感度の高い神経心理学的テストは、通常、遅延想起を伴う言語学習のテストです。比較すると、即時記憶または作業記憶がより長くそのまま残るため、桁範囲のテストは通常、初期段階では正常になります。実行機能と言語の流暢さの検査はアルツハイマー病の初期から中期段階で損なわれ、言語の流暢さの欠陥は病気の経過を通じてより高度な失語症に進行します。アルツハイマー病の中期から後期では、神経心理学的検査により、広範囲の個々の検査にわたって全体的な認知障害のプロファイルが明らかになります。
*遺伝子検査
理想的には、アルツハイマー病の遺伝子検査の目的は、症状が現れる前に病気を検出するか、病気にかかる相対的な可能性を判断することです。その後、遺伝子検査を使用して診断を確認したり、診断を除外したりできるようになります。検査が実施される場合には、インフォームド・コンセント、機密保持の保証、および結果が得られる前後の遺伝カウンセリングが重要である。残念なことに、遺伝子検査は倫理的および実際的な懸念が数多くあるため、依然として物議を醸しています。したがって、ほとんどの臨床医は、日常的な認知症精密検査の一部としての使用を推奨していません。
アルツハイマー病の遺伝学を再検討すると、検査の限界が浮き彫りになります。 50 歳未満の若年性アルツハイマー病患者(アルツハイマー病の全症例の 1% 未満)の場合、最も考えられる遺伝的原因は、染色体 14 上のプレセニリン 1 遺伝子の変異です。しかし、多くの変異が考えられます。遺伝子上で発生する可能性があるため、既知の異常な配列と一致しない場合、特定の遺伝子配列は無意味であることが判明する可能性があります。全症例の5%未満に相当する50歳から60歳の若年性ADの場合、遺伝子検査では、それぞれ染色体14および1上のプレセニリン1および2の遺伝子を完全に配列決定する必要がある。特定の変異の検索における染色体 21 上の APP について。このテストには費用がかかり、収量も確実ではありません。さらに、若年性アルツハイマー病、特に常染色体優性型のアルツハイマー病を持つ家族のほとんどは、遺伝的リスクについてすでに知っています。
遅発性アルツハイマー病の場合、利用可能な唯一の遺伝子検査は、APOE ε4 対立遺伝子に対するものです。このような情報は認知症患者の診断の確実性を高める可能性があるが、既存の検査には、診断の信頼性を 5 ~ 10% 以上高める感度と特異度の両方が欠けています。病歴、検査、神経心理学的検査を組み合わせることで、すでに十分な場合があります。認知的に正常な人がAPOE ε4対立遺伝子に関してヘテロ接合性またはホモ接合性であるという知識は、アルツハイマー病になることに対する不安を増大させるかもしれないが、それはリスクの増加を示すだけであり、実際的な解決策は何もない。さらに、保険会社がこの情報を入手できると、表向きは差別につながる可能性があります。遺伝子検査の倫理については、第 17 章で詳しく説明します。
-------------
キーポイント
「アルツハイマー病のリスク評価と教育」または「REVEAL」研究の結果は、遺伝子検査が適切に行われた場合、つまり教育、カウンセリング、機密保持が伴った場合、個人や家族に役立つ情報を提供できるが、必ずしもそうであるとは限らないことを示しています。不安を増大させる。遺伝子検査の実際的な利点の 1 つは、APOE ε4 対立遺伝子の検査結果が陽性だった人は、長期介護保険を取得または増額する可能性が高いことでした (Roberts et. al. 2005)。
-------------
*バイオマーカー
バイオマーカーは、診断を行うためにサンプリングまたは測定できる AD の解剖学的または機能的産物を表します。理想的なバイオマーカーは、正確で、信頼性があり、容易に入手可能で、安価である必要があります。また、実際にアルツハイマー病(過敏症)を患っている個人を特定し、アルツハイマー病を他の疾患と区別する臨床医の能力も向上させる必要がある。現在の慣行に対する(特異性)。現在、臨床診断の感度は 85% ~ 90% であるため、改善は差し迫った必要性はありません。むしろ、バイオマーカーの主な利点は、より迅速に、あるいはそれ以上の情報を提供できることです。
100 セクション II / 認知症のサブタイプ
確かに、診断。抗コリン薬点眼薬に反応した瞳孔散大の測定、アミロイド検出のための皮膚生検の実施、ジストロフィー性嗅上皮神経突起のサンプリングなど、そのような検査の多くが登場しては、時間の経過とともに消えていきました。これらのテストはいずれも、前述した理想的なバイオマーカーの目標を満たしていませんでした。現在使用されている唯一のバイオマーカーは次のとおりです。
・Aβ(脳脊髄液(CSF)で測定);
・タウタンパク質(CSFで測定)。
・神経糸タンパク質/AD7C-NTP (CSFおよび尿で測定)。
AD患者のCSFで見られる典型的なパターンは、Aβ42レベルの低下(斑内に結合しているため)とタウタンパク質の増加です。ただし、このパターンは他の条件でも発生するため、情報は限られています。さらに、CSF サンプルを取得するには、Aβ およびタウタンパク質レベルの血液または尿検査の使用を裏付けるデータが不足しているため、侵襲的な脊髄穿刺が必要です。さらに特異性の低い検査では、AD7C-NTP の尿または CSF レベルを測定します。AD7C-NTP は、ニューロンの長軸索突起に存在し、神経原線維変化に関連するタンパク質です。このタンパク質は神経細胞の修復に関与しているため、アルツハイマー病やその他の症状で増加する可能性があると推測されています。食品医薬品局の諮問委員会は、AD に対する十分な感度と特異性が欠如しているため、AD7C-NTP 検査を承認しないことを決定しました。
より最近の研究では、罹患者に見られる 23 種類のタンパク質のパターンに基づいて、脳脊髄液中の AD の「指紋」が特定されました。このパターンは、AD 患者 10 人中 9 人を正確に特定できましたが、3 人は誤って特定されました。侵襲的処置の必要性と限られた量のデータを考慮すると、この検査が有用であるかどうかを判断するには時期尚早です。
*脳波検査
脳波検査はADの診断には一般的には使用されませんが、鑑別診断においてせん妄が強く疑われる場合には推奨される場合があります。特徴的な所見には、バックグラウンドのアルファ活動 (8 Hz) が遅くなり、病気が進行するにつれて遅くなり続け、組織が崩壊することが含まれます。シータおよびデルタ活性の存在の増加も観察されます。

