8 アルツハイマー病の治療
-------------
重要な概念
・多くの戦略がアルツハイマー病 (AD) にかかるリスクを軽減する可能性がありますが、AD が臨床的に発症した後の有用性はより限定的です。
・アルツハイマー病には治療法はありませんが、アセチルコリンエステラーゼ阻害剤とグルタミン酸受容体拮抗薬のメマンチン(ナメンダ)は、認知、機能、行動の障害などの症状を安定化または改善する効果が証明されています。
・新たな選択的Ap42低下剤(SALA)など、アルツハイマー病の実際の病態を対象とした臨床試験中の薬剤の数が増えている。
-------------
AD は依然として不治の病ですが、治療できないわけではありません。理想的には、臨床医は病気の発症を最初から防ぎたいと考えていますが、臨床症状が現れる前に病気に罹患している個人を特定することはまだ不可能です。ただし、アルツハイマー病のリスクがより高い一部の個人は特定でき、そのリスクを軽減できるライフスタイルや食事の要因が多数あります (第 7 章および表 7.4 を参照)。この章では、アルツハイマー病のリスクをさらに軽減できる物質も多数説明します。しかし、臨床症状が現れると、治療アプローチはさらに限定されます。アルツハイマー病の症状を安定化および/または改善できる、アセチルコリンエステラーゼ阻害剤やグルタミン酸受容体拮抗薬メマンチンなど、米国食品医薬品局 (FDA) が承認した医薬品がいくつか入手可能です。この章では、これらの薬剤を概説し、それらを使用する際の実践的なヒントを提供し、AD の治療、さらには治癒するために研究されている他の化合物と戦略について説明します。
*アルツハイマー病のリスクを軽減する
特定の要因がアルツハイマー病の発症リスクを高めるのと同様に、他の要因はそのリスクを軽減するか、または疾患の発症を鈍化させる神経保護の役割を果たす可能性があります。これらの要素はすべて第 7 章で説明され、表 7.4 にリストされています。たとえば、リスクを軽減するライフスタイル要因には、成人教育を含む社会的、身体的、知的活動への参加が含まれます。よりアクティブなライフスタイルは、脳の機能を最大限に高め、保護的な認知予備力を構築するために脳を鍛えるのに役立つ可能性があります。脳血管損傷の予防は、アルツハイマー病になるリスクを軽減したり、さらに悪化したりするのを防ぐ可能性もある。これは、高血圧、脂質レベルの上昇、糖尿病、喫煙などの血管危険因子の管理によって部分的に達成される。健康的な食事もアルツハイマー病のリスクを軽減できることが、研究でますます明らかになってきています。第 7 章で説明したように、これは一般に、健康的な魚 (オメガ 3 脂肪酸を含む) やオリーブオイル、ビタミン C や E などの抗酸化物質を含む果物や野菜が豊富な低脂肪、低カロリーの食事です。ナイアシン、葉酸、ビタミンB12も含まれています。特に葉酸とビタミンBの摂取は、ホモシステインの過剰レベルの制御に役立つ可能性があり、ホモシステインは心臓発作や脳卒中のリスクの5倍の増加、そして最近ではアルツハイマー病のリスクの3倍の増加に関連していると考えられています。地中海食には、これらの推奨事項の多くが含まれています。 1日1杯のワイン(植物栄養素レスベラトロールを含む)またはビールもアルツハイマー病のリスクを軽減する可能性がありますが、過剰摂取はリスクを高めます。
第 7 章で述べたように、タバコ使用の影響には議論の余地があります。喫煙は脳血管疾患のリスクを高めますが、ニコチンも供給し、脳内のコリン作動性伝達にプラスの効果をもたらします。齧歯動物と人間の両方がニコチンの影響下にある場合、個別の認知テストの成績が向上する傾向があることが多くの研究で示されています。しかし、いくつかの研究が喫煙とアルツハイマー病の発症率の間に逆相関があることを示しているという事実にもかかわらず、さらなる研究はこれらの発見を確認していません。
*アルツハイマー病の治療
これまでに検討された治療戦略は、疾患そのものを治療することよりも、アルツハイマー病を発症するリスクを軽減することを目的としていました。アルツハイマー病を治療するために、研究者らは、アルツハイマー病の症状発現を修正する方法、あるいは、毒性のある Aβ の蓄積と神経斑への凝集を引き起こすと考えられている経路の各段階を中断する方法を検討してきた。研究者らは最終的には、過剰リン酸化タウタンパク質の蓄積や神経原線維変化も防ぐ方法を見つけたいと考えている。現在、AD に対して FDA が承認している市販薬は 5 つだけです。これらのうち 4 つはアセチルコリンエステラーゼ (AChE) 阻害剤で、1 つはグルタミン酸受容体拮抗薬です。それらの使用法については、この章で詳しく説明します。近い将来に大きな期待をもたらす可能性のある多くの新しい薬剤を特定し、テストするための研究も開始されています。これらのエージェントの一部についてはこの章で説明しますが、より完全なリストについては表 8.1 を参照してください。表 8.1 にリストされている薬剤の多くは、有効性の欠如や副作用の問題のため、決して市場に投入されることはないことに留意してください。実際、リストに掲載されている薬剤の中には、すでに臨床試験から中止されているものもあります。
-------------
キーポイント
アルツハイマー病患者に精神的刺激を与えるために、非薬理学的戦略がよく使用され、その多くが全体的な幸福感を改善し、介護者の負担を軽減し、さらには程度の差こそあれ、アルツハイマー病の経過を改善することがわかっています。例としては、記憶訓練、回想グループ、音楽およびペット療法、グループ心理療法、社交活動、運動などが挙げられます。しかし、これらの戦略はすべて、集中的な認知リハビリテーションであっても、せいぜい短期的な効果しか得られないことが示されている。それでも、2006年の米国老年精神医学会の「アルツハイマー病に起因する認知症患者のケアの原則」という立場表明で強調されているように、これらのアプローチは常に全体的な治療アプローチに組み込まれるべきである。その他の重要な非薬理学的アプローチについては、第 13 章から第 17 章で説明します。
-------------
*コリン作動性機能を強化するための戦略
第 7 章で説明されているように、コリン作動性仮説は、脳内のアセチルコリン (ACh) の欠乏が AD に見られる認知障害の主な原因であると仮定しています。約40年前、研究者らはアルツハイマー病患者の脳でコリン作動性機能の低下が起こっていることを初めて認識した。死後の脳サンプルにおけるコリンアセチルトランスフェラーゼの欠損に関する観察として始まったものは、コリン作動性細胞体が病気の過程によって破壊されたという認識へと成長した。
-------------表8.1


-------------表8.1続き1
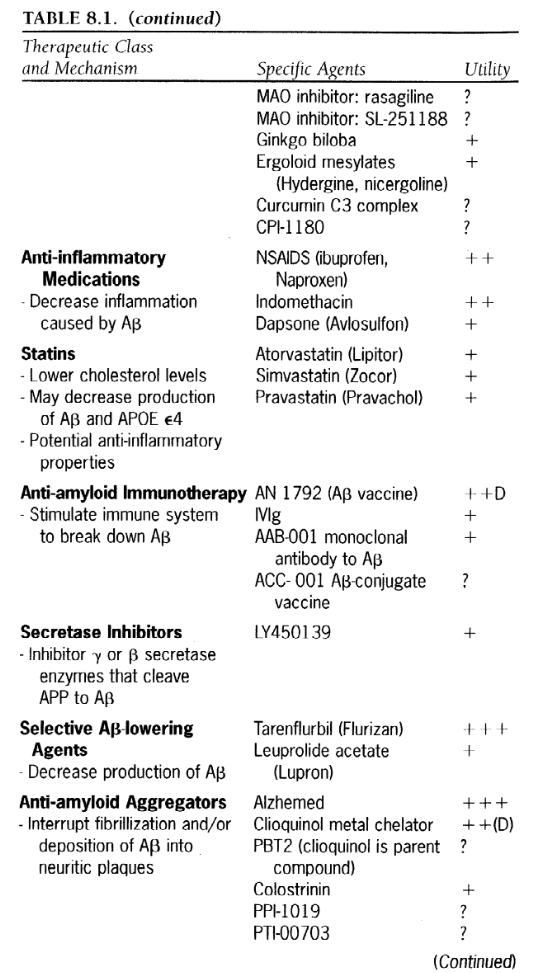

-------------表8.2続き2


-------------表8.2続き3
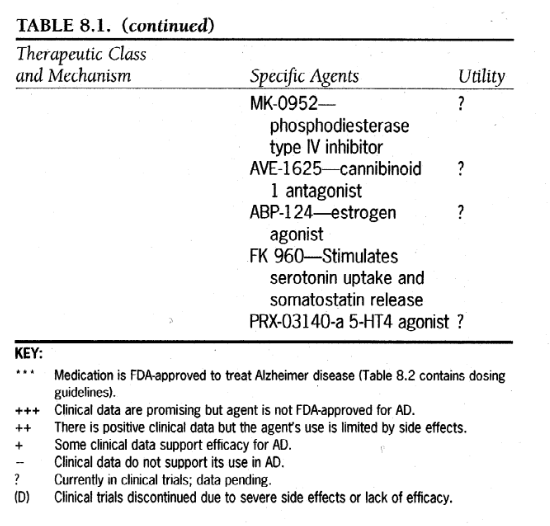

-------------
実際、アルツハイマー病患者の脳では ACh 濃度が 90% 減少します。コリン作動性仮説のさらなる証拠は、抗コリン作動薬の静脈内投与(IV)によって誘発された認知障害がコリン作動性解毒剤によって回復できるという事実にあります。したがって、治療の目標は、脳内の ACh レベルを増加させることによって AD の認知障害を改善することです。これを達成するには、次の 3 つの戦略が考えられます: (a) ACh の合成と放出を増加させる、(b) 酵素アセチルコリンエステラーゼ (AChE) を阻害することで ACh 分解をブロックする、および (c) コリン作動性受容体アゴニストを活性化してコリン作動性伝達を増加させるムスカリン受容体またはニコチン受容体のいずれか。
研究者らが考案した最初の戦略は、AChE阻害剤フィゾスチグミン(Antilirium)のIV投与で、AChの代謝を阻害することでAChを増加させた。研究では、この治療法が認知機能テストである程度の改善につながり、スコポラミンなどの抗コリン薬の認知効果を逆転させる可能性があることが示されました。しかし、アルツハイマー病の進行に対して明らかな効果はありませんでした。たとえ静注フィゾスチグミンでアルツハイマー病を治療できるとしても、その半減期が非常に短い(20~120分)こと、静注の必要性、顕著なコリン作動性副作用(吐き気、嘔吐、下痢など)を考慮すると、その使用は非現実的である。 、発汗、紅潮、徐脈)。長時間作用型のフィゾスチグミン (シナプトン) も研究されていますが、現在、アルツハイマー病の治療には推奨されていません。アルツハイマー病における潜在的な使用とは別に、IV フィゾスチグミンは薬物誘発性抗コリン作動性せん妄を逆転させるために臨床的に使用されています。
他の戦略では、レシチン (ホスファチジルコリン) やコリンなどの ACh 前駆体が使用されており、どちらも健康食品店で広く入手できます。しかし、これらの前駆体の経口使用がアルツハイマー病患者に利益をもたらすことは見出されなかった。さらに、レシチンには特に厄介な副作用が 1 つあります。魚油に由来するため、大量に摂取すると生臭さを発する可能性があります。研究では、AChの合成と放出に関与するミトコンドリアに存在するタンパク質、アセチル-L-カルニチンにも注目しています。当初、AD 患者 130 名を対象とした二重盲検プラセボ対照研究において、アセチル-1-カルニチンはプラセボよりもある程度の利点を示しました。しかし、さらなるデータは裏付けになっていません。試験済みまたは臨床試験中のムスカリン受容体アゴニストやニコチン受容体アゴニストも多数ありますが、AD に対して明確な有効性を実証したものはまだありません。これらのいくつかを表 8.1 に示します。
*アセチルコリンエステラーゼ(AChE)阻害剤
AChE阻害剤はADを治癒しませんが、豊富なデータは、AChE阻害剤がAD患者の生活と全体的なケアに重要な有益な効果をもたらし得ることを明らかに示しています。研究では、すべての AChE 阻害剤について次の利点が一貫して示されています。
・プラセボと比較して、10~12か月間の認知の改善および/または安定化、その後の症状の低下の程度の長期的な減少。
・機能的能力の向上および/または安定化。
・プラセボと比較して全体的な(全体的な)改善。
・問題行動の有病率の安定化。
・老人ホームへの入居が遅れる。
・介護者のストレスや負担が軽減される。
・介護者の休憩時間の増加。
・全体的なコスト削減。
現在市販されている 4 つの AChE 阻害剤はすべて、脳内の ACh レベルを増加させることによって作用すると考えられています。リバスチグミン(エクセロン)は、疾患の後期段階でより蔓延する可能性がある関連酵素ブチリルコリンエステラーゼも阻害します。ガランタミン (ラザダイン ER) は、ACh 放出の促進に関連するシナプス前ニコチン性受容体のアロステリックモジュレーターとしても機能します。一般的に使用される 3 種類の AChE 阻害剤の投与戦略を表 8.2 に示します。
AChE阻害剤は末梢のAChレベルを上昇させる可能性があるため、潜在的な副作用には、胃酸分泌の増加、気管支分泌の増加、徐脈性不整脈を悪化させる可能性がある心臓への迷走神経作用、およびサクシニルコリンの効果の増強が含まれる。麻酔。最も一般的な副作用は通常、吐き気、嘔吐、食欲不振、下痢などの胃腸関連のものです。ゆっくりとした滴定と食事による投与により、これらの影響の頻度と重症度を軽減できます。副作用が発生した場合でも、個人の耐性が高まるにつれて副作用は数日後に軽減する傾向があり、または一時的に用量を減らすことで軽減される場合もあります。ただし、活動性の消化性潰瘍疾患、不安定な徐脈、急性肺疾患、またはうっ血性心不全のある人の治療の開始は避けるべきです。 AChE 阻害剤による治療は、後者の病状が安定している場合に適切である可能性があります。
FDAは、AChE阻害剤などのアルツハイマー病治療薬の臨床試験において、アルツハイマー病評価尺度、認知下位尺度(ADAS-Cog)での被験者の認知能力と、全体評価尺度(GES)での全体的な改善を測定することを義務付けている。 ADAS-Cog は、記憶、見当識、言語、日常生活機能の領域を評価する 11 項目、70 点のスケールです。典型的なアルツハイマー病患者は、年間 7 ~ 10 ポイント増加する可能性があります。臨床的に有意な改善は、少なくとも 4 ポイントの低下によって示されます。 AChE阻害剤に関する研究では、機能、行動、介護者の負担の尺度も検討されています。 AChE 阻害剤を投与された個人とプラセボを投与された個人の典型的な経過を図 8.1 にグラフで示します。これは、患者が後で実薬を投与された場合の AD の経過の変化も示しています。このグラフは、現在市販されているすべての AChE 阻害剤を使用したすべての研究にわたる一貫した結果を表しています。一般に、AChE阻害剤は、平均的な患者の症状を10~12か月間、ベースライン以上またはベースライン以上に改善または安定させ、その後、治療を受けていない平均的な患者と並行して、しかし常にそれよりも良好な、ゆっくりではあるが着実な減少を続けます。プラセボを服用し、その後 AChE 阻害剤を投与された患者は改善しますが、以前に開始された患者のレベルには決して達しません。 AChE阻害剤の使用を中止すると、パフォーマンスのレベルは急速に低下し、以前に治療を受けていない人のパフォーマンスのレベルに近づきます。本質的に、アルツハイマー病で失われた認知スキルは決して回復しないため、AChE阻害剤を早期に継続的に使用することの根拠となっている。臨床医は、患者を治療するときに、潜在的な利点がすぐに認識できない場合でも、このグラフを念頭に置いておく必要があります。最長 5 年間にわたる長期的なデータでは、AChE 阻害剤の継続的な利点が示されていることを思い出してください。
-------------表8.2
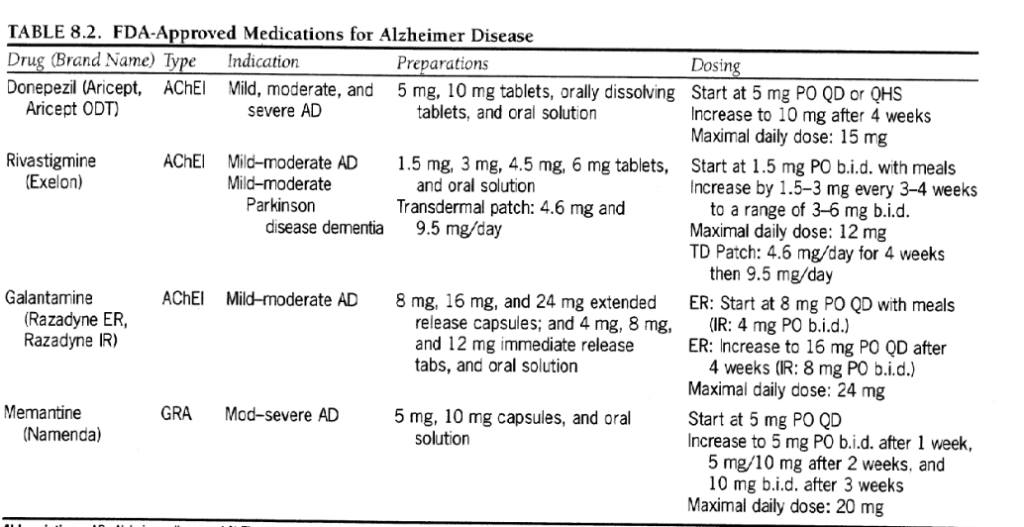
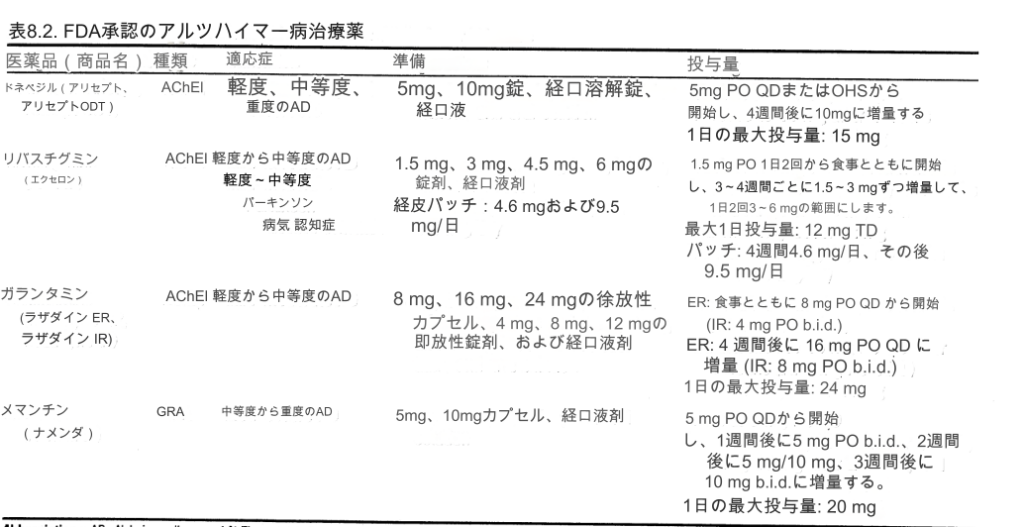
表8.2 FDA が承認したアルツハイマー病治療薬
-------------
多くの研究研究はまた、AChE阻害剤が、より重度のAD、血管因子を伴うAD、血管性認知症、レビー小体型認知症、およびパーキンソン病による認知症の患者に認知的、機能的、そして場合によっては行動的な利益をもたらすことを示している。 AChE阻害剤が軽度認知障害(MCI)患者やせん妄患者に有益であるかどうかは、あまり明確ではない。すべての AChE 阻害剤は、グルタミン酸受容体拮抗薬メマンチン (Namenda) と組み合わせて安全に摂取できます。以下の AChE 阻害剤はすべて軽度から中等度の AD の治療として FDA に承認されており、そのうち 1 つは重度の AD に対しても承認されています。
– – – – – – -図 8.1.
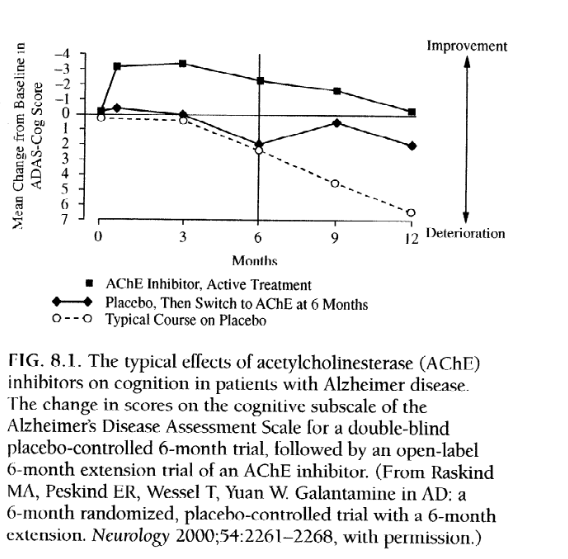
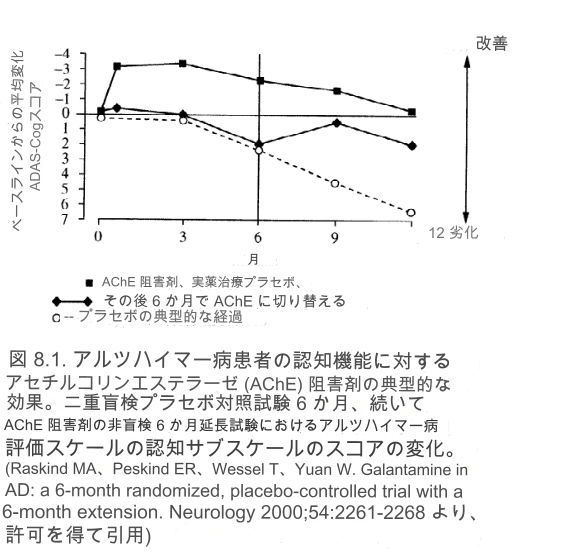
図8.1.患者の認知に対するアセチルコリンエステラーゼ(AChE)阻害剤の典型的な影響
アルツハイマー病。二重盲検プラセボ対照の6か月試験とその後のAChE阻害剤の非盲検6か月延長試験におけるアルツハイマー病評価スケールの認知サブスケールのスコアの変化。 (AD における Raskind MA、Peskind ER、Wessel T、Yuan W. Galant包より: 6 か月の延長を伴う 6 か月のランダム化プラセボ対照試験。Neurology 2000;54:2261-2268、許可を得て。)
-------------
-------------
キーポイント
AChE阻害剤で患者を治療する場合、治癒や、さらには減少速度の劇的な変化を期待することは避けてください。そのような期待を抱くと必ず失望し、おそらく治療を途中でやめてしまうかもしれません。次のたとえを考えてみましょう。あなたの患者は、底に穴の開いたボートに座っていて、ゆっくりと沈んでいます。穴を塞いで水の侵入を止める方法はありません(つまり、治療法はありません)が、水を汲み出すことで、長期間水に浮かんでいられるようにすることはできます。本質的に、これは患者の認知能力を、薬を服用していない場合よりも長く「浮かせた」状態に保つために行っていることです。
-------------
*タクリン (コグネックス) は可逆的な AChE 阻害剤であり、1992 年に初めて市場に投入されました。軽度から中等度の AD 患者を対象とした臨床試験では、タクリンを服用している患者の方が ADAS-Cog と GES で有意に良好な成績を収めていることが判明しました。プラセボを投与されている人よりも。投与量は、10 mgを経口で1日4回(1日あたり40 mg)から開始し、4〜6週間ごとに80、120、160 mgを4回に分けて経口で増量します。一般的な副作用には、吐き気、嘔吐、下痢、消化不良、頭痛、筋肉痛などがあります。タクリンは、投薬中の人のほぼ 50% が肝トランスアミナーゼの上昇を経験しているため、現在は広く使用されていませんが、この問題は新しい AChE 阻害剤では発生しません。
*市場に登場した 2 番目の可逆的 AChE 阻害剤であるドネペジル (アリセプト) は、タクリンと同様に、ADAS-Cog および GES においてプラセボよりも優れていることが判明しました。軽度、中等度、重度のアルツハイマー病の治療用として FDA から承認されています。データは、治療を受けた患者の 82% が認知力の改善を経験したか、または低下を感じなかったことを示しています。より最近のデータでは、日常生活機能と問題行動の両方が安定していることが実証されています。ドネペジルを服用している患者を対象とした長期研究では、アルツハイマー病の症状は進行し続けているものの、薬物治療を行っている場合は常に減少曲線が良好であることが示されています。一般に、ドネペジルは忍容性が高く、最も一般的な副作用としては、吐き気、嘔吐、下痢、頭痛、不眠症、鮮明な夢、めまいなどが挙げられます。半減期が 70 時間のドネペジルは、1 日 1 回、経口で 1 日あたり 5 mg から始めて、許容される場合は 4 ~ 6 週間後に 10 mg まで増量できます。一部の臨床医は、朝または夜に経口摂取し、1日あたり15 mgという用量を推奨しています。ドネペジルは肝機能に重大な影響を与えず、重大な薬物相互作用もありません。
・市場で 3 番目の AChE 阻害剤であるリバスチグミン (Exelon) は、可逆的な AChE およびブチリルコリンエステラーゼ阻害剤です。前任者と同様に、臨床試験では、ADAS-Cog と GES の両方においてリバスチグミンがプラセボよりも優れていることが判明しました。さらに、リバスチグミンを用いた臨床試験では、日常生活機能と行動上の問題が安定することが実証されています。中程度に重度のアルツハイマー病の症状を持つ患者も、認知と行動の両方の点で利点を示しています。さらに、リバスチグミンはパーキンソン病に伴う認知症にも適応があります。リバスチグミンの半減期は 1.5 時間と短いですが、コリンエステラーゼ阻害持続時間は 10 時間です。投与量は、1.5 mg を 1 日 2 回経口で開始し、忍容性に応じて 3 ~ 4 週間ごとに 1 日 2 回 3、4.5、および 6 mg まで増量します。比較的厳格な漸増スケジュールを伴う臨床試験では、リバスチグミンは吐き気、嘔吐、食欲不振、体重減少などの重大な胃腸への影響と関連していた。これらは最も頻繁に起こる副作用である傾向がありますが、ゆっくりとした用量設定と食事と一緒に投与することでリスクを最小限に抑えることができます。さらに、副作用は治療の過程で頻度が低くなります。 1 日 1 回の経皮リバスチグミン パッチは、臨床試験で有効性と忍容性が良好であることが示されており、現在 4.6 mg/24 時間および 9.5 mg/24 時間の強度で入手可能です。
・ガランタミン (ラザダイン ER) は、市場で 4 番目の可逆的 AChE 阻害剤でした。これは、AChE 阻害剤として機能し、シナプス前のニコチン受容体を活性化することによってコリン作動性活性を潜在的に増加させるという二重の作用機序を持っています。他のすべての AChE 阻害剤と同様に、ADAS-Cog と GES を使用した臨床試験では、ガランタミンがプラセボよりも優れていることが判明しました。さらに、ガランタミンは機能上の問題と行動上の問題の両方を安定させることがわかっています。持続放出型のガランタミン(ラザダイン ER)は、食事とともに 1 日 1 回 8 mg 経口投与から開始し、4 週間後に 1 日 1 回経口 16 mg まで増量されます。即時放出型ガランタミン(以前はレミニルという名前で販売されていましたが、現在はラザダイン IR として販売されています)も入手可能で、1 日 2 回投与されます(4 週間は 4 mg を 1 日 2 回、その後は 8 mg を 1 日 2 回)。臨床医には、1 日 1 回経口投与で用量を 24 mg に増やすという選択肢もあります。臨床試験に参加し、1日あたり24mgの用量を摂取した被験者は、統計的に有意な差ではなかったものの、数値的にはテストの成績が良かった。他の AChE 阻害剤と同様、副作用は通常、胃腸に関連します。ケトコナゾール、エリスロマイシン、およびパロキセチンは、ガランタミンの濃度を上昇させる可能性がある併用薬ですが、ガランタミンの用量を減らすことが必ずしも必要というわけではありません。代わりに、患者をより綿密に監視することが保証されます。
-------------
ヒント
ある AChE 阻害剤は別の AChE 阻害剤よりも優れていますか?切り替えたほうがいいでしょうか?研究では、いずれかの AChE 阻害剤が別の AChE 阻害剤よりも優れているという決定的な実証はされていません。したがって、症状を改善するためにあるAChE阻害剤から別のAChE阻害剤に自動的に切り替えることを推奨する明確な根拠は存在しない。ただし、有効性を理由に切り替えることにした場合は、最初の薬剤を推奨最大用量まで投与したことを確認してください。それでも変更する予定がある場合は、1 日目に既存の薬剤を中止し、2 日目に開始用量で新しい薬剤を開始することで、きれいな切り替えを行うことができます。副作用のために切り替える場合は、元の薬剤を中止し、再使用できるようにします。新しい薬剤を開始する前に副作用が治まるようにする必要があります。
-------------
*その他のAChE阻害剤およびコリン作動性薬剤
他にもいくつかの AChE 阻害剤が研究されていますが、ツーベルナクリンとエプタスチグミンは重大な副作用を伴うため、今後の市場投入が妨げられる可能性があります。フェンセリンは AChE 阻害剤であり、APP 産生も減少させる可能性がありますが、第 III 相試験では失敗しました。ガンスチグミンとフペルジン A は臨床試験中です。メトリホネートは、AChE に結合して、長期にわたる阻害を通じて徐々に用量依存的なコリン模倣効果をもたらす有機リン酸塩剤です。メトリフォネートはアルツハイマー病の症状に優れた有効性を持つよく研究された薬剤であるにもかかわらず、重篤な副作用のため FDA の承認を得るプロセスから外されました。 ACh受容体のムスカリン性サブタイプを直接活性化することでコリン作動性機能を増強する2つの薬剤、キサノメリンとオキソトレモリンは、アルツハイマー病患者においてある程度の改善を示しているが、その一貫性はAChE阻害剤よりも低く、重大な副作用が伴う。研究されている他の 2 つの薬剤には、コリン アセチルトランスフェラーゼ刺激薬であるネフィラセタムと、ACh アゴニストであるプラミラセタムが含まれます。完全なリストについては、表 8.1 を参照してください。
*グルタミン酸受容体拮抗薬
グルタミン酸は脳内の主要な興奮性神経伝達物質であり、シナプスの約 40% に存在します。グルタミン酸は、ACh と同様に、学習と記憶に関連する神経経路において特に重要な神経伝達物質です。しかし、アルツハイマー病では、興奮毒性と呼ばれる異常なグルタミン酸伝達が、過剰な細胞カルシウム流入を介してニューロンを損傷および破壊し、Aβ産生を促進する働きをします。したがって、AD に対する論理的な治療アプローチは、グルタミン酸または NMDA (N-メチル-D-アスパラギン酸) 受容体に作用する薬剤でこの興奮毒性をブロックすることです。
*メマンチン (Namenda) は現在、AD 治療用として FDA に承認された唯一のグルタミン酸または NMDA 受容体拮抗薬です。これは、中等度から重度のアルツハイマー病に対して承認されている 2 つの薬剤のうちの 1 つです。メマンチンは、NMDA 受容体カルシウムチャネルに対して低から中程度の親和性を持つ非競合的アンタゴニストであり、ニューロンへの過剰なカルシウム流入をブロックしながら、正常な神経伝達を可能にすることによってグルタミン作動性伝達を調節する働きをします。研究では、メマンチンはプラセボと比較して中等度に進行したアルツハイマー病患者の認知症状、機能症状、行動症状の治療に有効であり、忍容性も良好であることが実証されています。最も一般的な副作用には、鎮静、混乱、頭痛、便秘などがあります。
多くの患者において、最初の鎮静および/または混乱は軽度かつ一時的なものである傾向があります。メマンチンとの薬物間相互作用は最小限です。メマンチンの用量は、食事の有無にかかわらず、1日1回5 mg経口から開始し、1週間後に1日2回5 mg経口、1週間後に10 mg/5 mgに増量され、その後目標用量の10 mg経口1日2回に増量されます。さらに 1 週間後 (表 8.2 に投与ガイドラインの概要を示します)。メマンチンは単独療法として使用することも、AChE 阻害剤と安全に併用することもできます。 24週間の研究では、メマンチンとドネペジルの併用療法では、ドネペジルとプラセボを併用した場合と比較して、ベースラインを超えて認知機能と機能が大幅に安定化することがわかりました。興味深い発見の 1 つは、併用療法を受けた患者はドネペジル単独の患者よりも副作用、特に胃腸の副作用が少なかったことです。ネラメキサンは、現在研究されている別の NMDA 受容体アンタゴニストです。
-------------
-------------
-------------
ヒント
標準治療は、メマンチンと AChE 阻害剤を組み合わせることです。どの薬剤を最初に開始するかについての明確なガイドラインはありませんが、通常、軽度から中等度の AD では AChE 阻害剤が最初に開始され、後でメマンチンが追加され、中等度から重度の AD ではその逆が開始されます。これら 2 種類の薬剤は作用機序が異なるため、相互に作用し合うことに留意してください。
-------------
*抗アミロイド戦略
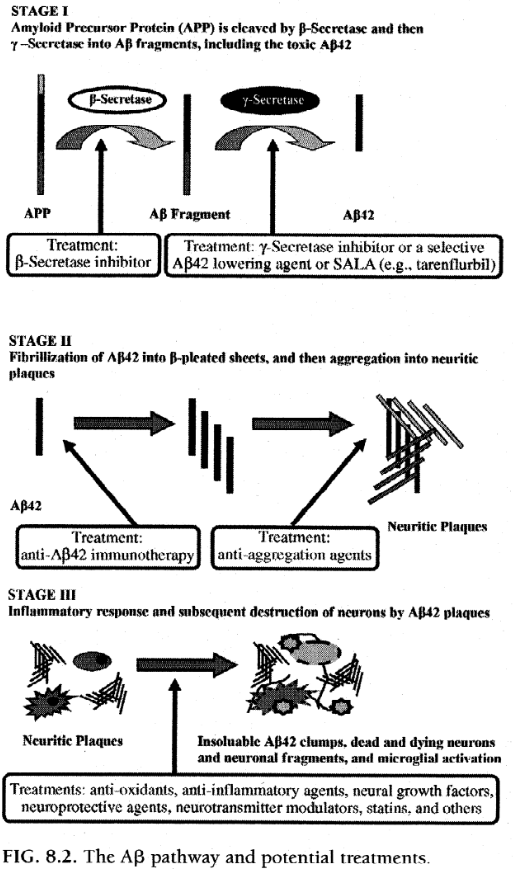
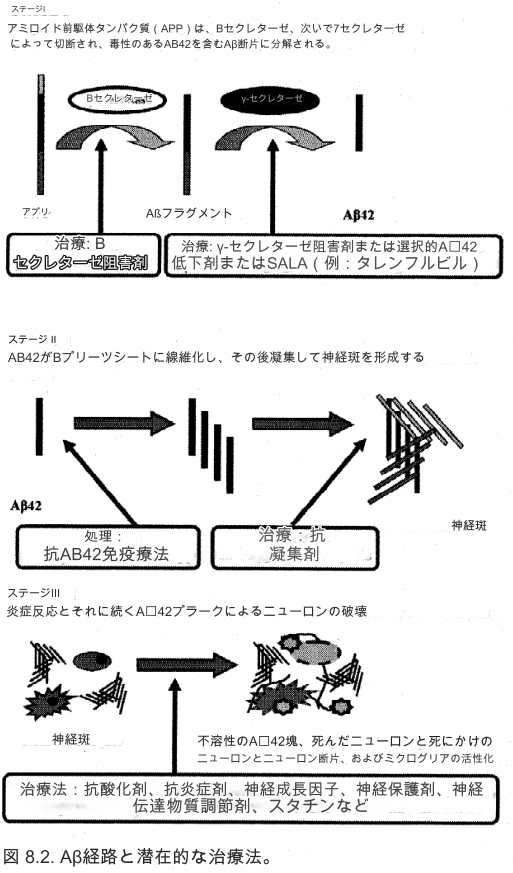
アルツハイマー病治療の次の段階は、単に症状を調節するのではなく、実際に病気のプロセス自体を標的にすることになるでしょう。この目的を達成するために、主な原因であると考えられている有毒な Aβ42 タンパク質の蓄積を予防または中断することに多くの治療戦略が焦点を当てています。これらの戦略のいくつかは実際に市場投入にかなり近づいており、特に最終的に病気の経過の非常に早い段階で、あるいは症状が発現する前に適用されれば、アルツハイマー病の治療に大きな変革をもたらす可能性があります。後者のアプローチは、症状が始まる前にアルツハイマー病患者を特定する診断技術の開発に依存します。図 8.2 は、これらの開発戦略が Aβ42 経路内にどのように適合するかを示しています。
*セクレターゼ阻害剤
APP から Aβ42 への切断に関与すると考えられている酵素である B-セクレターゼおよび/またはγ-セクレターゼをブロックすることによって Aβ42 の形成を減少させる可能性のあるいくつかの薬剤が開発されています。
LY450139は現在臨床試験中の非選択的γ-セクレターゼ阻害剤であるが、認知機能とCSF Aβ42レベルを調べた初期のデータではプラセボとの有意な差は示されていない。 LY450139 は忍容性が良好でしたが、γ-セクレターゼ阻害剤に関する懸念の 1 つは、多くの重要な生理学的プロセスにおけるその役割を考慮すると、有害事象の可能性です。
*選択的Aβ42低下剤(SALAS)
治療のもう 1 つの目標は、γ-セクレターゼの作用を阻害する代わりに、その作用を十分に変更して Aβ42 産生を低下させることです。 Tarenflurbil (Flurizan) は、市場に登場する可能性のある選択的 Aβ42 低下剤または SALA の新しいカテゴリーの最初の薬剤です。タレンフルビルは、APP 切断を有毒な Aβ42 の生成から遠ざけ、代わりに Aβ38 などの毒性の低いタンパク質断片を生成するようにシフトするγ-セクレターゼのアロステリックモジュレーターです。軽度から中等度のアルツハイマー病患者207名を対象にタレンフルビルを1日2回400または800mgの用量で投与した12ヶ月の第II相二重盲検プラセボ対照試験では、軽度障害のある人(MMSE>20)では高用量の方が体重の減少が少ないことが判明した。 ADAS-Cog や日常生活の活動と全身機能を測定するスケールを含む、すべての結果測定。臨床試験の参加者にはAChE阻害剤の投与が許可された。タレンフルルビルは忍容性が高く、副作用の点ではプラセボと同等でした。より一般的な副作用には、一過性の好酸球増加症、軽度の貧血、血圧上昇、皮膚発疹などが含まれます。 1600人のアルツハイマー病患者を対象に、タレンフルルビル800mgを1日2回、プラセボと比較して18か月にわたって投与する第III相試験も完了した。これらのデータに基づくと、タレンフルビルは市場で最初の SALA となる可能性があります。
*抗アミロイド凝集剤
神経炎斑を形成するタンパク質原線維への AB42 の凝集を防ぐいくつかの薬剤が現在研究されています。 Alzhemed は、Aβ に結合して線維化を防ぐ小さな有機分子であり、抗炎症特性も持つ可能性があります。軽度から中等度のアルツハイマー病患者を対象としたアルゼメドの非盲検延長を伴う3カ月間の二重盲検プラセボ対照第II相試験では、両方のADASにおいてCSF AB42が最大70%減少し、認知機能低下が低下したことが示された。 -Cog および MMSE スコア。さらに大規模な第III相試験が実施されている。
クリオキノールは銅キレート剤およびキノロン系抗生物質であり、亜急性骨髄視神経障害という重篤な副作用のため、1970年代初頭に米国市場から撤退しました。細胞外の銅とそれに結合している亜鉛を除去することで、Aβ42の凝集と毒性を妨げると考えられています。予備データでは、認知能力の向上が示されています。臨床試験は薬剤に不純物が含まれているため保留されているが、クリオキノールの誘導体を含む他の金属キレート剤が開発されている。
コロストリニンは羊の初乳に由来するポリペプチドであり、Aβ42の凝集を停止すると考えられています。 105人の軽度から中等度のアルツハイマー病患者を対象とした15週間のプラセボ対照試験とそれに続く15週間の非盲検相では、コロストリニン群の被験者の40%で症状の安定または改善が示されたのに対し、プラセボ群の20%が症状の安定化または改善を示した。しかし、その有用性についての評決はまだ出ていない。
*抗アミロイド免疫療法
AD の治療戦略として関心が高まり、治癒の可能性が期待されているのは、AB42 に対するワクチンの開発です。この興奮は、脳内に Aβ42 プラークを発症するトランスジェニック マウスを治療するために作られたワクチンが、脳内の AB42 の蓄積を予防するだけでなく除去し、以前の認知機能を回復することが判明した後に始まりました。しかし、数人の被験者が髄膜脳炎を発症し、数人が死亡したため、このワクチンのヒトに対する第II相試験は2002年に突然中止された。時期尚早の終結にもかかわらず、この研究では、ワクチンに対して免疫反応を示した被験者は、プラセボを投与された被験者と比較して、いくつかの記憶テストでより良い成績を収めたことが判明した。これらの人々はまた、脳スキャンで脳サイズの減少を示し、これはおそらく Aβ42 の分解を示し、脳脊髄液 (CSF) 中のタウタンパク質レベルの低下はおそらく神経細胞死の減少を示しています。さらに、いくつかの被験者の解剖も行われます。彼らは、脳から AB42 が除去されることを実証しました (神経原線維変化は除去されませんでした)。
実際の Aβ42 を含むワクチンを投与する代わりに、数種類の受動免疫療法が現在研究されています。 1 つのアプローチでは、Aβ42 に対する高濃度のヒト抗体を含む免疫グロブリン (IVIg) を患者に IV 注入する方法と、もう 1 つのアプローチでは、Aβ42 に対するヒト化モノクローナル抗体を注射する方法があります。アルツハイマー病患者の小規模コホートを対象とした IVIg を用いた 6 か月の臨床試験の初期データでは、注入の忍容性が良好であるだけでなく、認知機能の改善と CSF AB42 レベルの低下にも関連していることがわかりました。さらに臨床試験が進行中です。
**その他の治療戦略
*抗酸化療法
酸化メカニズムは、加齢に伴う神経変性と Aβ の両方の原因として提案されています。たとえば、AD 患者の脳では、Aβ が細胞毒性のある過酸化水素やその他のフリーラジカルを生成する可能性があります。ある理論では、ビタミン E (α-トコフェロール) やセレギリン (エルデプリル、選択的 MAO B 阻害剤) などの抗酸化物質には、脳へのフリーラジカルによる損傷を鈍らせることで神経保護効果がある可能性があることが示唆されています。ある研究では、中等度の重度のアルツハイマー病患者341人に、ビタミンEを1日2000IU(1000IUを1日2回)、セレギリンを1日10mg、その両方、またはプラセボのいずれかを2年間投与した。測定されたエンドポイントには、日常生活活動の喪失、より重度の認知症、長期介護、死亡が含まれます。ビタミンEとセレギリンは両方ともアルツハイマー病の進行をいくつかのエンドポイントまで遅らせ、それぞれの薬剤を単独で使用した方が、組み合わせて使用した場合よりも良い結果が得られました。どちらの薬剤でも、認知機能の測定における利点は見つかりませんでした。認知的利益の欠如は、高用量のビタミンEサプリメントを摂取した閉経後の女性の研究でも見られました。
明らかに、ビタミン E がアルツハイマー病を予防したり、病気の進行を大幅に遅らせたりすることを示唆する証拠はまだありません。存在する唯一の証拠は、高用量のビタミンEが軽度の機能改善をもたらす可能性があることを示唆しています。マルチビタミンを摂取しているほとんどの人は、ビタミン E の 1 日あたりの推奨摂取量である 15 ~ 45 IU を摂取していますが、実際にサプリメントを摂取している人は 1 日あたり 200 ~ 800 IU を摂取している可能性があります。しかし、この研究では5~10倍の用量が使用されました。ビタミンEの中枢神経系への浸透力が低いため、このような高用量が必要になる可能性があります。ビタミン E は、高用量でも忍容性が高い傾向がありますが、吐き気、下痢、疲労、筋力低下、打撲などの副作用が生じる可能性があります。ビタミンEを抗凝固薬と組み合わせると、出血がさらに懸念されます。
現在、アルツハイマー病の治療法としてビタミンEとセレン、およびカレーに含まれる抗酸化物質クルクミンC3複合体を検討する臨床試験が行われています。
*MAO阻害剤
セレギリン (エルデプリル、L-デプレニル、EMSAM) は、代謝酵素モノアミンオキシダーゼ B (MAO-B) を選択的に阻害することにより、脳内のカテコールアミンを増加させます。この能力において、それは抗うつ薬(ノルエピネフリンのレベルを高めるため)およびパーキンソン病の治療法(ドーパミンのレベルを高めるため)として使用されてきた。 AD では、MAO-B 活性が大幅に増加し、モノアミンの酸化的脱アミノ化が促進される可能性があります。その結果生じるフリーラジカルの増加により、神経細胞の損傷が増加する可能性があります。上述の臨床試験で指摘されているように、セレギリンはアルツハイマー病の機能低下率を低下させ、老人ホームへの入所を遅らせることが示されました。高齢患者におけるセレギリンの主な制限は、その副作用プロファイルである可能性があります。 MAO 阻害剤の一般的な副作用には、吐き気、体重増加、起立性低下などがあります。さらに、MAO阻害剤は、チラミンを含む食品(熟成チーズ、ワインなど)や、選択的セロトニン再取り込み阻害剤、抗うつ剤、交感神経興奮剤などの特定の薬剤と組み合わせると、潜在的に致死的な高血圧発症を引き起こす可能性があります。 。セレギリンは、アンフェタミンがその代謝産物の 1 つであるため、人によっては非常に活性化する場合もあります。しかし、セレギリンは選択的 MAO-B 阻害剤であるため、非選択的 MAO 阻害剤よりも安全なプロファイルを有しており、食事制限を行う必要もなく、高いリスクもなく 10 mg もの用量で使用できます。高血圧の危機。高齢者の典型的な 1 日の投与量は 5 ~ 10 mg であるため、この安全範囲は役に立ちます。残念なことに、セレギリンから得られる潜在的な利益はせいぜい控えめであり、たとえ低用量であっても、ほとんどの医師と多くの薬剤師は高血圧クリーゼのわずかな可能性を心配しています。実際には、セレギリンは AD の治療法として推奨されておらず、広く受け入れられていません。 AD に関して試験されている別の MAO 阻害剤はラサギリンです。
*抗炎症剤
実質的な証拠は、Aβの存在によって引き起こされ、免疫系によって媒介される炎症過程がADの病因において重要な役割を果たすことを示している。したがって、論理的な結論は、抗炎症薬はアルツハイマー病の発症リスクを軽減するか、または炎症によって引き起こされる損傷を改善するのに役立つ可能性があるということです。実際、研究者らは、関節リウマチ患者におけるアルツハイマー病の発症率の低下は、非ステロイド性抗炎症薬(NSAID)の長期使用の直接の結果であると仮説を立てています。 NSAID(主にイブプロフェン)、アスピリン、およびアセトアミノフェンを少なくとも2年間服用した場合の縦断的研究では、NSAIDの使用期間が増加するにつれてアルツハイマー病の相対リスクは減少しましたが、アスピリンまたはアセトアミノフェンの使用では減少しませんでした。他の研究では、インドメタシンとアスピリンの使用に利点があることがわかっています。セレコキシブ (Celebrex) やロフェコキシブ (Vioxx、2004 年に米国市場から撤退) などのシクロオキシゲナーゼ 2 阻害剤は、イブプロフェンで見られたものに匹敵する結果を示せませんでした。他の前向き研究では、AD に関する NSAID の実際の予防または保護の役割に疑問が投げかけられています。さらに、長期使用による胃炎やその他の重篤な副作用のリスクがその利点をはるかに上回る可能性があります。 NSAID を使用すべきかどうかについてはまだ判決は下されておらず、現在、AD 予防には推奨されていません。
*エストロゲン
エストロゲンがアルツハイマー病のリスク軽減に役割を果たす可能性がある理論的理由は数多くあります。これには、神経成長とシナプス形成の潜在的な促進、記憶形成の促進、脳血流の増加、抗酸化特性などが含まれます。驚くべきことではないが、エストロゲン受容体は認知に関連する脳領域に存在します。当初、いくつかの研究は、閉経後のエストロゲン補充療法(ERT)とアルツハイマー病発症の相対リスクとの間に逆相関があることを実証した。 10件の研究からの累積データをレビューしたメタ分析では、ERTの使用によりリスクが29%減少することが示唆されました。 ERTを受けている472人の女性を対象とした別の研究では、アルツハイマー病発症リスクが54%減少したことが判明した。しかし、これらの所見は、ERT(結合型馬エストロゲンからなる)とプロゲスチン(メドロキシプロゲステロン)を摂取している50歳から79歳までの16,000人を超える閉経後の女性をプラセボと比較して調べたウィメンズ・ヘルス・イニシアチブ研究によって否定された。この研究は、ホルモン補充療法を併用した女性で乳がん、心臓発作、血栓、脳卒中のリスクが大幅に増加したことを研究者らが指摘した後、2002年に突然中止された(ERT単独の女性でも同様の結果が得られた)。さらに、治療グループではMCIと認知症の両方を発症するリスクが増加しました。
この証拠を考慮すると、エストロゲンの使用は女性のアルツハイマー病の予防治療として日常的に促進されていません。 NSAID の使用と同様に、アルツハイマー病に対するエストロゲンの潜在的な利点と、卵巣癌や乳癌のリスク増加などの潜在的な副作用を比較検討する必要があります。多くの女性はさまざまな理由から単に ERT の候補者として適していません。また、他の女性も潜在的ながんリスクをますます懸念するようになり、これまでに報告されている閉経後の女性に対する利点に対する懐疑的な見方が高まっています。
*スタチン
コレステロール値の上昇は、おそらく AB の生成を刺激することにより、AD の危険因子であると考えられています。また、高コレステロール血症は脳血管疾患のリスクを高め、それ自体がアルツハイマー病の危険因子である可能性もあります。そこで、コレステロール値を下げると Aβ の産生が低下し、ひいてはアルツハイマー病のリスクが低下する可能性があることが提案され、げっ歯類の研究によって裏付けられました。実際、遡及的研究では、コレステロールを低下させる 3-ヒドロキシ-3-メチルグルタリル コエンザイム A (HMG-CoA) レダクターゼ阻害剤またはスタチンの使用は、アルツハイマー病のリスクを最大 70% 大幅に低下させることが示されています。 2つの研究でリスクが低いと報告されています。すべての研究でスタチンの使用でそのような肯定的な結果が得られたわけではありません。たとえば、高齢者におけるシンバスタチン (Zocor) とプラバスタチン (Pravachol) の使用に関するある研究では、5 年間にわたって認知機能の低下を遅らせる効果は見られませんでした。アルツハイマー病患者におけるスタチン使用の前向き試験では、リスク軽減以外にもさまざまな結果が得られています。ある研究では、アトルバスタチン(リピトール)を服用しているアルツハイマー病患者の小規模コホートの少なくとも半数では、1年間にわたって認知機能の低下が鈍化したことがわかりました。別の前向き二重盲検プラセボ対照試験では、アルツハイマー病患者にシンバスタチンを26週間にわたって投与した。シンバスタチンは、軽度のアルツハイマー病患者においてプラセボと比較して、MMSE レベルの低下が遅く、脳脊髄液中の Aβ40 レベルが大幅に低下することと関連していた。ただし、標準ADAS-Cogの全体的なスコアは、シンバスタチン群とプラセボ群の間で差はありませんでした。
ADに対するスタチンの正確なメカニズムは明らかではありません。一方では、スタチンは主に肝臓でのコレステロール生成を阻害することによってコレステロール値を低下させます。スタチンはまた、AB 形成ではなく正常な APP 分解を促進するα-セクレターゼを活性化し、APOE β4 の合成を妨害することにより、脳内の Aβ 代謝に直接影響を与える可能性があります。さらに、スタチンには抗炎症特性があることが提案されています。
最後に注意しなければならないのは、実際にスタチン使用の副作用として記憶障害があり、中止すると回復するという報告例が発表されているということである。この関連性は証明されておらず、さらなる研究が必要ですが、臨床医はその可能性に注意する必要があります。
*イチョウ
中国医学では、イチョウの葉からの抽出物が脳機能に効果があるという仮説を立てて何千年も使用されてきました。最新の研究では、イチョウ葉エキスには抗酸化作用と抗炎症作用の両方があり、脳循環を増加させる可能性があることが示唆されています。軽度から中等度の認知症患者を対象としたイチョウ葉の52週間無作為化二重盲検プラセボ対照研究において、40mgのイチョウ葉を1日3回摂取した被験者は、認知機能の尺度において極めて小さいながらも統計的に有意な差を示したプラセボ群との比較。イチョウ葉はプラセボと比較して忍容性が良好でした。しかし、多くの人がイチョウ葉を摂取しているという事実にもかかわらず、追加の研究ではアルツハイマー病におけるイチョウ葉の利点を裏付けるデータはまだ提供されていません。その結果、ほとんどの記憶障害センターではイチョウ葉エキスを定期的に処方していません。 「天然ハーブ抽出物」と表示されているため、多くの人が安全だと思い込んでいますが、イチョウ葉には凝固障害や麻酔との有害な相互作用が関係しています。
*エルゴロイドメシル酸塩
メシル酸エルゴロイド (ヒデルギン) は、麦角 (ライ麦菌) のいくつかの水素添加アルカロイドで構成されており、1970 年代には認知症の治療法として一般的でした。ヨーロッパでは依然として認知症の治療法として人気があり、ニセルゴリン(セルミオン)と呼ばれる同様の麦角誘導体に加えて販売されています。作用機序はまだ解明されていませんが、エルゴロイドメシル酸塩は脳血管拡張剤として働き、抗酸化特性も持っている可能性があると考えられています。
エルゴロイドメシル酸塩は、二重盲検およびプラセボ対照による7件を含む多数の臨床試験で研究されています。後者の試験では、被験者の少なくとも 50% である程度の改善が実証されました。アルツハイマー病患者において、エルゴロイドメシル酸塩の認知および行動への影響は比較的軽度でした。血管性認知症では、認知と行動の両方がわずかな改善を示しました。エルゴロイドメシル酸塩の研究に関するある批判的なレビューは、裏付けとなるデータを強調しているが、これまでの研究の多くは一貫した診断方法のない少量のサンプルで構成されているとも指摘している。エルゴロイドメシル酸塩の有効性にも疑問が投げかけられており、特にアセチルコリンエステラーゼ阻害剤の出現以来、その使用が大幅に減少している原因となっている可能性がある。
エルゴロイドメシル酸塩の用量は 1 日あたり 1.5 ~ 12 mg の範囲ですが、最も一般的な用量は 1 日あたり 3 ~ 6 mg を 3 回に分けて投与します (1 ~ 2 mg を 1 日 3 回)。 4.5 mg 錠剤および経口溶液としても販売されています。エルゴロイドメシル酸塩は、長期間使用しても比較的安全な副作用プロファイルを持っています。最も一般的な副作用には、軽度の吐き気やその他の胃腸障害、頭痛などがあります。
*その他のアプローチ
現在研究中のアルツハイマー病に対する新たな治療法が他にもいくつかあります。神経成長因子 (NGF) は、AD によって生じた損傷の一部を修復できる可能性があります。レテプリニム カリウム (ネオトロフィン) は神経成長因子を増加させる薬剤であり、細胞培養中の Aβ レベルを低下させることが実証されています。アルツハイマー病患者を対象とした予備臨床試験では、ADAS-Cog と全体的な変化評価スケールの両方で改善が見られました。ただし、改善はプラセボと比較して統計的に有意なレベルには達しませんでした。ザリプロデンは、AD に関して研究されているもう 1 つの NGF アゴニストです。
特定の神経伝達物質の調節も、AD の治療に役割を果たす可能性があります。研究中の薬剤には、ガンマアミノ酪酸 (GABA) 受容体調節剤、セロトニン再取り込み刺激剤、ドーパミンおよびセロトニン再取り込み阻害剤、ソマトスタチン刺激剤などがあります。インスリン調節異常とアルツハイマー病に関する新たな考えを踏まえ、経口糖尿病薬と鼻腔内インスリンの両方がアルツハイマー病の治療法として研究されています。他の新しい戦略には、星状細胞機能の調節因子である薬剤、神経特異的カルシウムチャネル遮断薬、ホスホジエステラーゼIV型阻害薬、カンニビノイドアゴニスト、およびAβ42形成を阻害すると理論づけられている抗アンドロゲン酢酸ロイプロリド(Lupron)が含まれる。これらの薬剤はすべて現在臨床試験中です (表 8.1)。
*アルツハイマー病の治療ガイドライン
この章ですべてをまとめると、現在、AD 患者全員の治療には次の手順が推奨されています。
1. 個人は、果物や野菜を豊富に含むバランスのとれた食事の摂取、精神的および社会的に刺激的な活動、障害のレベルに適した身体的運動など、精神的および肉体的な健康と福祉を増進できる非薬理学的アプローチに従事する必要があります。
2. 血管危険因子(高血圧、糖尿病、高脂血症、肥満、喫煙)を最大限にコントロールし、転倒や事故による頭部外傷のリスクを軽減することにより、さらなる脳損傷から可能な限り保護されるべきである。
3. 十分な量のビタミン C、E、B12、葉酸、その他のビタミン B を確実に摂取するために、毎日マルチビタミンを摂取する必要があります (ただし、過剰なビタミン サプリメントや大量摂取は推奨されません)。
4. 一般的に処方される 3 つの AChE 阻害剤 (ドネペジル、リバスチグミン、またはガランタミン) のいずれかをメマンチンと組み合わせて服用する必要があります。
人によっては、AChE阻害剤とメマンチンの両方に耐性がない人もいますが、少なくとも耐性が最も高い薬剤のいずれかを単独で投与する必要があります。関連する精神障害の積極的な治療は重要であり、第 13 章から第 15 章で説明されていますが、介護者を支援するための重要な戦略は第 16 章と第 17 章で説明されています。アルツハイマー病患者の多くは表 8.1 にリストされている他の薬剤を服用していますが、人気のある薬剤はイチョウです。 上記のガイドラインを超えるものを推奨するには十分な証拠がありません。タレンフルルビルやその他の抗アミロイド剤のような SALA が間もなく市場に投入され、AD 治療における次の革命となる可能性があります。
-------------
ヒント
AChE 阻害剤および/またはメマンチンの投与を開始したら、6 ~ 9 か月後に有効性を再評価するのが合理的です。しかし、ほとんどの場合、臨床的に効果を検出するのが難しい場合でも、長期的なデータは持続的な効果を明確に裏付けているため、認知増強剤の投与を無期限に継続することは理にかなっています。重篤なアルツハイマー病状態になっても効果が持続する可能性があるため、これらの薬剤のいずれかをいつ中止するかを決定するのは困難です。病気の末期段階では、認知増強剤の使用を徐々に減らすことを検討するのが合理的かもしれませんが、たとえ病気がかなり進んだ段階であっても、認知、機能、行動制御の急激な喪失が起こり得ることに留意してください。 AD- エージェントが停止されると、元に戻すのが困難になる場合があります。
-------------

