要旨
うつ病が疾病行動の一形態であるのか、あるいはその結果であるのかという点は、翻訳的に重要な関心事である。疾病行動とは、感染や免疫外傷によって誘発され、炎症性サイトカインによって媒介される行動複合体である。それは、急性炎症と闘うためにエネルギーを節約することによって回復を促進する適応的な反応である。疾病行動とうつ病には、現象学的にかなりの類似点がある。たとえば、行動の抑制、食欲不振および体重減少、そしてメランコリー的(快楽喪失)、身体生理的-身体的(倦怠感、痛覚過敏、脱力感)、不安、神経認知症状などである。
しかしながら臨床的うつ病では、免疫-炎症経路の感作、脂質・タンパク質・DNAに対する酸化的およびニトロ化的ストレスによる進行性の損傷、そして自己エピトープに対する自己免疫応答への移行が起こる。これら後者のメカニズムは神経進行性プロセスの基盤であり、複数のうつ病エピソードが神経組織の損傷を引き起こし、その結果として機能的および認知的な後遺症をもたらす。したがって、共通の免疫-炎症経路が疾病行動の生理学とうつ病の病態生理学を支えており、それが両者の現象の一部が重複していることの説明となる。炎症は両義的な(ヤヌス的な)反応を引き起こす可能性があり、良性で急性の側面としては疾病行動を通じた保護的な炎症を生成し、悪性で慢性的な側面としては、たとえばうつ病のような、神経炎症および神経変性プロセスの間で正のフィードバックループが形成される生涯にわたる疾患を引き起こす。このような慢性的反応は、より不明確なトリガーに続いて生じる。
キーワード: うつ病、疾病行動、炎症、酸化ストレス、サイトカイン
序論
臨床的うつ病と疾病行動の間に現象学的な類似点があり、両者が共通の経路、すなわち炎症応答系(IRS)の活性化を共有している可能性があるという最初の兆しは、1993年に発表された [1,2]。疾病行動とは、典型的には急性感染や組織損傷によって多くの哺乳類種において誘発される行動複合体である。その特徴的な行動パターンには、脱力感、痛覚過敏、発熱、無気力、環境との社会的相互作用への無関心、嗜眠、行動の抑制、運動活動・探索行動・グルーミングの減少、生殖能力の低下、快楽喪失、傾眠および眠気、食欲不振および体重減少、集中力の欠如、不安などが含まれる。疾病行動は、IL-1、TNFα、IL-6などの炎症性サイトカイン(PICs)の作用を通じて媒介されるという証拠が存在する [3-10]。
この文脈において、臨床的うつ病が、PICsやC反応性タンパク質およびハプトグロビンといった急性期タンパク質のレベル上昇を含む、免疫-炎症性疾患であるという豊富な証拠がある [11-20]。
大うつ病の特徴的な症状には、食欲不振、体重減少、倦怠感、無気力、睡眠障害、痛覚過敏、運動活動の低下、集中力の欠如が含まれる(アメリカ精神医学会)。さらに、うつ病の「自律神経症状(ベジタティブ症状)」である食欲不振、体重減少、精神運動抑制は、臨床的うつ病において炎症マーカー、すなわち先述の3つのPICsによって合成が誘導される急性期タンパク質である血漿ハプトグロビンのレベル上昇と有意に関連している [1,2]。
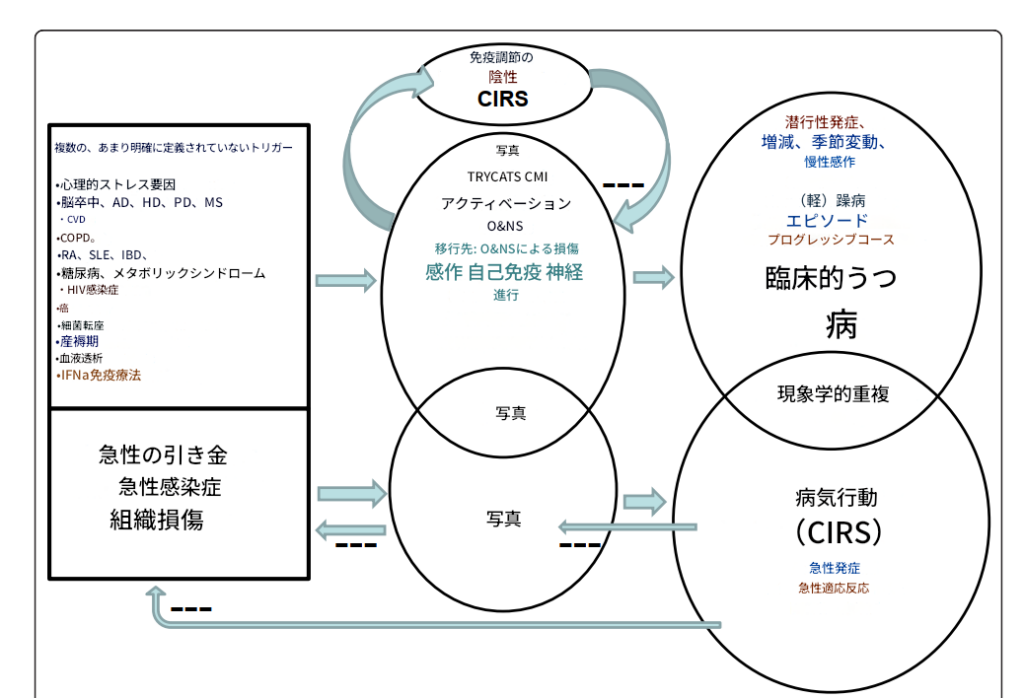
したがって、疾病行動とうつ病の間には、顕著な行動的および炎症的類似性が存在すると結論づけることができる [1,2,11]。そのため、一部の研究者は、臨床的うつ病を疾病行動の一形態あるいは疾病行動反応の結果であると見なしている [9]。図1は、主に炎症性トランスレーショナルモデルから導出された理論を示しており、炎症性トリガーがIRSを活性化し、PICsの産生を誘導し、それが疾病行動とうつ病を引き起こしうることを示しており、これらの状態の現象学的な重なりを説明する。
本論文の主な目的は以下の点を明らかにすることである:
a)臨床的うつ病と疾病行動の症状および行動上の類似点と相違点;
b)うつ病の段階化と疾病行動の経過との比較;
c)臨床的うつ病と疾病行動の両者を支える共通の免疫-炎症経路と、それらを識別する可能性のある要素;
d)両者の病因的要因。
疾病行動の本質
炎症性誘導因子、たとえば急性のウイルスおよび細菌感染や炎症性外傷などは、自然免疫系の受容体のようなセントリネル(見張り役)によって検出され、炎症性メディエーター、たとえば炎症性サイトカイン(PICs)を活性化し、それらは炎症を起こしている組織の免疫細胞を標的とする [21]。適応的な炎症反応は、トリガーが排除され、損傷した組織が修復されると終息する。この現象は「炎症の解消(resolution of inflammation)」として知られている。本節で説明するように、PICによって誘導される疾病行動は、炎症の解消および炎症時のエネルギー需要増加において重要な役割を果たす。
疾病とエネルギー消費
病原体の脅威と闘うことは大量のエネルギーを消費するため、利用可能なエネルギーを配分する必要がある [22]。たとえばTNFαシグナルのようなPICシグナルは、この増加したエネルギー需要とエネルギー供給とのバランスを調節し、食物摂取、エネルギー消費、および基質の利用を制御する [23,24]。PICsは、この著しく高まったエネルギー需要において中心的な役割を果たしており、これは負のエネルギーバランス(脂肪分解の増加、組織タンパク質の喪失および筋タンパク質合成の低下、糖新生)と、自発的なエネルギー使用の減少によって特徴づけられる [22]。
中枢神経系(CNS)は、PICによる求心性迷走神経シグナルの活性化、孤束核の感覚核に対するTNFαの効果、そして3つのPICすべてが異なる経路を通じて脳に到達することを通して、末梢の炎症反応に関する神経的および体液性のシグナルを受け取る [22,25]。これらのPICsは、運動、神経認知、繁殖活動といったエネルギー消費的なプロセスを停止させる。その結果、代謝エネルギーは脳およびいくつかの末梢器官から引き下げられ、侵入した病原体の有害な影響に対抗するために再配分される。このプロセスによって節約されたエネルギーは、発熱(体温上昇)および免疫細胞の炎症状態の強化に貢献する [22]。
無気力、脱力感、傾眠、精神運動抑制、認知障害、性欲減退などの多くの疾病行動の症状は、運動的・性的・脳の活動を制限し、それにより代謝エネルギーを一次感染との闘いに振り向ける役割を果たしている [4,7,22,26]。免疫応答は高度にカロリー依存的であり、安静時のエネルギー消費を増加させる一方、疾病行動反応、たとえば運動の抑制などは重要なエネルギーを節約する可能性がある [27]。
-----F1
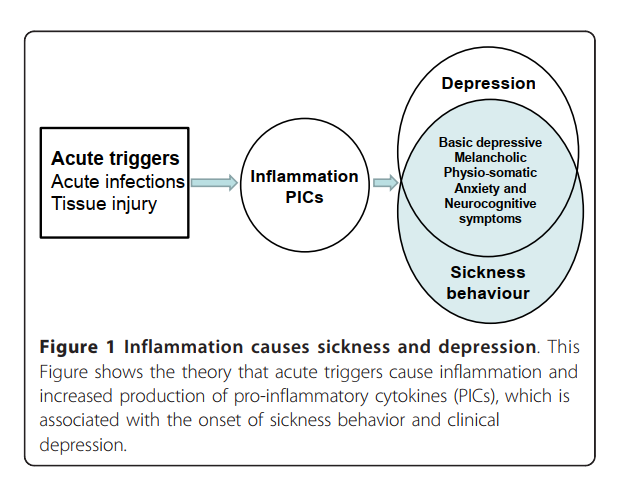
炎症が病気行動と抑うつを引き起こす
| 項目 | 説明 |
|---|---|
| 急性の引き金 | 急性感染症 組織損傷 |
| ⬇ | 炎症(Inflammation) 炎症性サイトカイン(PICs)の産生増加 |
| ⬇ | 結果として現れる行動・症状 |
| 病気行動(Sickness behavior) | 基本的抑うつ症状、メランコリック症状、身体・生理症状、不安、神経認知症状と一部が重なる |
| 抑うつ(Depression) | 病気行動の要素を含みつつ、より広範な精神症状を伴う |
この図は、急性の引き金(感染や損傷)が炎症反応を誘発し、炎症性サイトカイン(PICs)の増加を通じて、病気行動および臨床的抑うつの発症につながるという理論を示しています。
-----
疾病行動と発熱
軽度から中等度の発熱(高熱とは対照的に)は、宿主の防御機能および感染への抵抗力を強化することにより、たとえば多形核白血球の貪食作用および運動性、細菌の殺傷およびウイルス複製の防止を促進することで、正の適応的反応である [28–30]。さらに、PICsやインターフェロン(IFNs)などのサイトカインは、発熱時により活性化される [31]。発熱性のIL-1と非発熱性のIL-18、ならびにそれらの内因性阻害因子の中枢神経系内の部位ごとの相対的バランスは、発熱の有無および程度に寄与している可能性がある [32]。過去には、感染症と闘うために患者に意図的に発熱を起こさせることさえあった。
疾病行動と食欲不振および体重減少
炎症によって誘発される食欲不振は、障害の大きさに比例し、また障害前の体重とは反比例の関係にある [33]。食欲不振は、鉄の摂取を制限することによって、細菌の増殖を促進する鉄の活性化を防ぐ可能性があると示唆されている [34]。鉄は、細菌の成長に利用される栄養素の一つである。しかしながらこの推論は極めて憶測的であり、なぜなら食事由来の鉄の吸収率は1%未満であり、鉄の状態は時間をかけてゆっくりと変化するからである。より妥当な適応機能としては、食欲不振がカロリー制限を通じて、炎症や疾病行動につながる様々な細胞内シグナル経路を弱めるということが挙げられる [35,36]。実際、2週間のカロリー制限は、IL-6を含む炎症性経路を有意に抑制する [37]。カロリー制限は、抗炎症状態を誘導することにより、リポポリサッカライド(LPS)誘導性疾病行動を用量依存的に抑制する [36]。
運動の抑制および食欲不振は、除脂肪体重の減少、タンパク質の異化亢進、体タンパク質および脂肪の喪失につながり得る。これらは総合的に炎症によって引き起こされる体重減少および最終的には悪液質の説明となる。短期的には、食事の内容ではなく体重の減少が炎症反応を弱める。たとえば、IL-6やTNFといった炎症性PICsを減少させ、脂肪組織由来の抗炎症性タンパク質であるアディポネクチンの血漿濃度を上昇させることが挙げられる [38–41]。
図2は、急性炎症によって誘発される疾病行動のさまざまな機能を示している。すなわち、疾病行動は急性の炎症性トリガーに対する短期的な反応であり、これらのトリガーおよびそれに伴う負のエネルギーバランスに対処するために誘導される適応的な動機づけ状態である [4,7]。この恒常性維持を目的とした適応的行動反応は、進化を通じて種を超えて保存されており、文化を越えて予測可能な形で生じる [26]。
ーーーーーF2
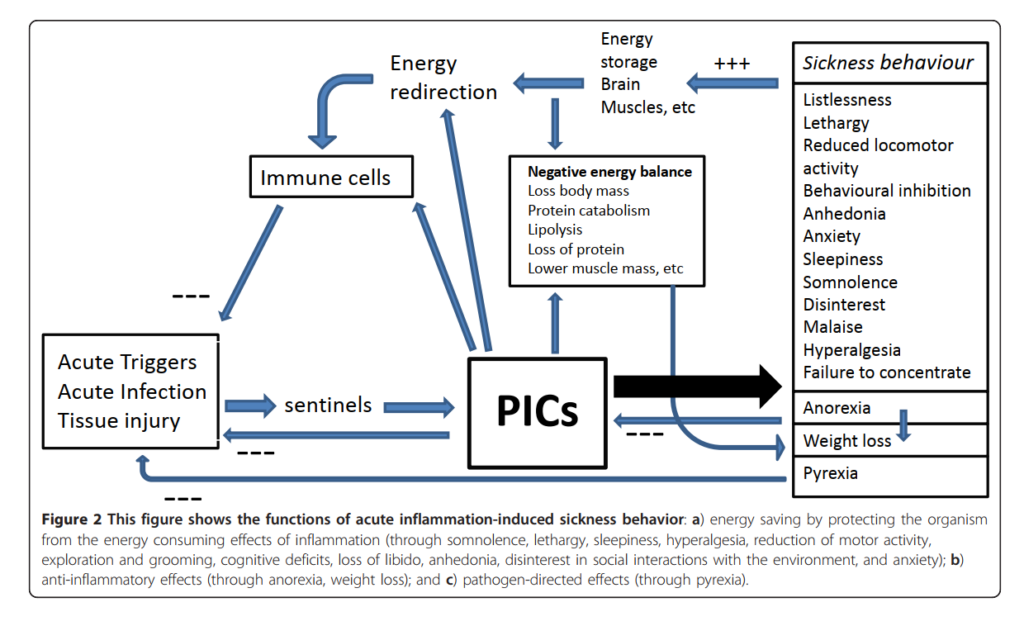
ーーーーーT1
表1:うつ病と疾病行動の特徴
| 特徴カテゴリ | うつ病 | 疾病行動 |
|---|---|---|
| 基本的な症状 | ほとんど一日中気分が落ち込むほとんどすべての活動に対する興味や喜びの減退食欲不振または過食、著しい体重の減少または増加不眠または過眠精神運動性の興奮または抑制疲労感またはエネルギーの喪失思考力や集中力の低下 | 社会的交流への無関心食欲不振および体重減少;体重増加はなし眠気運動活動の減少;興奮なし無気力集中力の低下 |
| 実存的症状 | 無価値感や罪悪感の感情自殺念慮または行動 | ― |
| メランコリー次元 | 特有の質の喜びの喪失(アネドニア)反応性の欠如日内変動早朝覚醒精神運動抑制過剰な体重減少 | 甘味飲料の摂取減少(アネドニア)行動抑制――運動活動と探索行動の減少重要な体重減少 |
| 不安次元 | 緊張;生理的行動;呼吸器症状;泌尿器症状;自律神経症状;面接時の不安行動(一般) | 不安 |
| 身体症状次元 | インフルエンザ様の倦怠感;痛みと筋肉の緊張(患者の一部) | 倦怠感および痛覚過敏(疾病行動の主要症状) |
| 発熱(発熱症) | わずかな体温上昇 | 発熱 |
| 発症 | 徐々に進行 | 急性発症 |
| 経過 | 寛解と再発を繰り返す波状または再発性の経過慢性化エピソードの感作季節変動(軽)躁エピソード | 急性適応反応(最大19~43日)長引くこともあるが、不適応なものとなる可能性あり――― |
| 経路 | (亜)慢性炎症およびサイトカインの増加細胞性免疫の活性化炎症性および細胞性免疫経路の感作トリプトファン代謝経路(TRYCAT)の活性化酸化およびニトロ酸化ストレスの損傷自己免疫神経新生の障害 | サイトカインの増加による急性炎症活性化された細胞性免疫―TRYCAT経路が活性化される可能性あり不明だがおそらく関与―― |
| 引き金 | 多因子的、明確ではない心理社会的ストレス、医学的炎症性疾患、神経炎症性障害、炎症状態 | 急性で明確に定義された引き金病原体や組織損傷 |
| 一般的特徴 | トリガーから自立する傾向炎症関連の慢性進行性障害 | 常に明確なトリガーへの反応進化的に保存された炎症誘発性適応行動反応 |
| 良性/悪性の側面 | 悪性の「慢性」側面:神経炎症と神経変性過程間の正のフィードバックループをもつ慢性障害 | 良性の「急性」側面:免疫細胞へのエネルギーの移動を助け、エネルギーを節約し、エネルギーバランスを維持、トリガーの除去を助け、抗炎症作用を持つ |
ーーーーー
うつ病と疾病行動の症状的/行動的な類似点と相違点
精神障害の診断と統計マニュアル(DSM IV-TR、アメリカ精神医学会)は、精神障害の診断において最も一般的に使用されている診断体系の一つであり、臨床的うつ病の診断は、9つの基本症状のうち少なくとも5つが、少なくとも2週間持続した場合に下されると規定している。表1は、これら9つの基本症状と、それらの基本症状に重ね合わされる可能性のある3つの部分的に重複する症状次元、すなわち:1)メランコリー(抑うつ的);2)不安;3)身体-身体症状(フィジオソマティック)次元を示している [15]。多変量統計解析(パターン認識手法)により、臨床的うつ病の基本症状およびこれら3つの症状次元は確認および検証されていることを強調しておくべきである [42–44]。これら3つの次元は、たとえばメランコリー、不安、または身体-身体症状的特徴を持つうつ病など、特定のうつ病サブグループを描き出しており、それらはバイオマーカーによって外的に検証されている。
表1は、臨床的うつ病の症状と疾病行動の特徴を比較している。臨床的うつ病の基本的な症状/行動は、疾病行動においても観察される。たとえば、食欲不振、体重減少、運動活動および探索行動の減少、疲労、眠気、集中力の欠如などである。さらに、3つの症状次元に属する症状、たとえばメランコリー(快刺激への反応の欠如、過度の精神運動抑制および体重減少)、不安、身体-身体症状(倦怠感および痛覚過敏)も疾病行動中に見られる。
うつ病と疾病行動の明確な違いの一つは発熱である。しかしながら、重度のうつ病患者では健常者と比較して体温が高いという報告もある。すなわち、それぞれ98.38 ± 0.61華氏度 対 98.13 ± 0.59華氏度(平均 ± 標準偏差)(すなわち、36.88°C 対 36.74°C)である [45]。臨床的うつ病における体温上昇は、Szubaらによっても示されている [46]。しかしながら、臨床的うつ病患者における明確な発熱の決定的証拠は存在していない。
明白な違いには、自殺念慮、罪悪感および無価値感などがあり、これらはうつ病の特異的な実存状態を示す症状である [26]。この文脈において注目すべきは、Charltonが提唱した「うつ病の倦怠感理論(malaise theory of depression)」である。すなわち、疾病行動の中心的症状である倦怠感は、うつ病の中核「感情」として考慮されるべきだという理論である。実際、インフルエンザ様の倦怠感や感染の主観的な感覚は、他の身体-身体症状とともに、臨床的うつ病において重要な症状次元である [44]。倦怠感理論では、気分の低下およびより特異的な実存的状態としてのうつ病は、倦怠感の産物であると見なされている。すなわち、疾病行動を経験しているが自身が病気であることに気づいていない人間は、自らのエネルギーの欠如や神経認知障害を個人的な失敗と解釈し、その結果、罪悪感や無価値感を抱くことになる [26]。
推論上、この理論はうつ病を情動障害としてではなく、疾病行動に関連する身体的障害として考えている。しかしながら、多変量統計解析によると、倦怠感を含む身体-身体症状を示すのは、うつ病患者の一部にすぎない [44]。これらの所見は、倦怠感がうつ病の中核感情であるという見解と対立している。
うつ病の段階的進行と疾病行動の経過の比較
一部の患者は1回限りのうつ病エピソードにしか悩まされないこともあるが、過去20年間に行われた縦断的研究では、臨床的うつ病は一般的に反復性または生涯にわたる疾患であることが示されている [47–49]。うつ病は古典的には短期間(6~9ヶ月)で自然に治癒する障害と考えられていたが、その経過は著しく変動する。うつ病は、長期間にわたるエピソード(慢性うつ病)の形を取ることもあり、うつ病エピソードが頻繁に再発することもある(反復性うつ病)。さらに、うつ病患者の最大15%が治療抵抗性に発展する可能性がある。治療抵抗性とは、少なくとも2回の適切な抗うつ薬治療に反応しないことと定義される [50]。
うつ病患者の一部のサブグループは、さらに軽躁または躁病エピソード(双極性うつ病)を経験することがあり、これには異常に高揚した気分、エネルギー、認知が含まれる;またはうつ病症状と(軽)躁病症状が同時に現れる混合状態を呈することもある。脳は最も代謝的に活発な組織の一つであり、エネルギーと気分は密接に関連していることを強調すべきである。うつ病は脳のエネルギー産生の低下と関連し、躁状態はエネルギー消費の増加と関連する [51]。一方、疾病行動はエネルギーを節約する行動応答である。
単極性および双極性うつ病の両者には進行性疾患としての特徴がある。これらはしばしば、軽度または非特異的な症状から始まり、次に閾値未満の症状の前駆的特徴に進行し、急性エピソード、再発、あるいは持続的で緩解しない慢性の形へと至る段階をたどる [16,17,48]。うつ病の発症が早いこと、エピソードの持続時間や回数が多いことは、さらなる再発に対する脆弱性の増加および予後の悪化と関連している [16,17,52]。この進行性の経過は、神経認知機能の低下を含む機能的悪化と関連している [53,54]。このような「増悪と軽快の繰り返し」のパターンは、自己免疫性、進行性、あるいは変性疾患の特徴でもあり、これらは潜行性の発症と再発性エピソード、または慢性的経過と機能障害のリスクの増加を特徴とする [11]。
さらに、感作(sensitization)はエピソード再発のモデルを提供するとする証拠がある [55]。感作とは、心理的または器質的なストレッサーへの繰り返しの曝露が、時間依存的にこれらのストレッサーへの再曝露に対する感受性を進行的に高めることを意味する [56,57]。McEwenのアロスタティック・ロード(全ostatic load)モデルも、この進行的パターンを説明するために応用されている [58]。また、単極性および双極性うつ病やうつ病サブグループ(たとえば産後うつ病)には季節変動がしばしば見られ、たとえば春にピークが現れる [59,60]。うつ病およびその症状の重症度、さらには自殺にも季節変動が見られる [61]。
一方、疾病行動は急性かつ短期的な状態であり、急性感染/外傷を対処するために生物学的に適切に発動され、回復を促進する。明らかに、(軽)躁症状、時間の経過による進行的な悪化、季節変動は、疾病行動の特徴ではない。疾病行動は長引いたり、不適切に活性化されたりすることがある。このような長期化した疾病行動複合体は、慢性感染や(自己)免疫障害の場合のように、機能不全に陥っている可能性が高い [26]。運動および活動の障害は、典型的には疾病行動と関連しており [62,63]、心疾患、関節リウマチ、がんを含む急性および慢性疾患において発現する疲労-うつ-睡眠障害クラスターの一部を形成している [64]。
これらの症状は、集中治療室(ICU)入院後や放射性物質の投与後などにおいて、数年にわたり持続することもある。一部の個人において、これらの状態が疾病行動とみなされるべきかどうかは疑問が残る。なぜなら、もはや生物学的に有益ではないからである。この疑問については、次節にて検討する。
臨床的うつ病と疾病行動を支える経路
炎症および細胞性免疫
ヒトおよびげっ歯類における研究により、炎症性サイトカイン(PICs)が疾病行動の中心的な媒介因子であることが明らかにされている [5,6,65–67]。炎症性の引き金は、「ニューロアクシス」、すなわち代謝、消化器、および心血管の課題に関する情報をストレス関連行動を媒介する脳領域へ伝達する上行性神経経路を誘導する [68,69]。たとえば、感染および免疫活性化は、末梢から延髄尾側の迷走神経背側複合体および腹外側延髄へと伝わる炎症性サイトカインによって媒介されるボトムアップの炎症性経路を活性化する [9,70–72]。これらの内臓機能への炎症性刺激は、内臓感覚性経路を介して脳へと変換され、それが疾病行動およびうつ病様・不安様行動を引き起こす [72]。
さらに、炎症性サイトカインは血管内皮細胞のトランスポーターによって脳へ積極的に運ばれるか、あるいは血液脳関門が欠損している領域を通じて拡散する可能性がある [25,72]。これにより、全身性炎症が神経炎症およびミクログリアの活性化を誘発する理由が説明される。たとえば、グラム陰性菌の細胞壁成分であるLPS(リポポリサッカライド)の投与は、神経炎症およびミクログリア活性化を引き起こすが、これはTNFαのレベル上昇によって特徴付けられ、数ヶ月間持続する可能性があり、疾病行動の発症と関連している [8]。
加えて、同じ経路が、感染誘発性の不安および脅威関連情報を媒介する脳領域、たとえば終条床核などを活性化する可能性がある [71,73–75]。急性疾患モデルにおけるこれらの行動障害のメカニズムを調査した研究では、末梢の炎症が、尾側脳幹に起源を持ち、視床下部を含む制御脳領域へと生理的ストレッサーの存在を伝達する「危険経路」の活性化を引き起こすことが示されている。この危険経路の活性化は、行動活性に関連する視床下部の覚醒システム、特に結節乳頭体ヒスタミン作動系を抑制する [68]。この危険経路の活性化が阻止されると、急性炎症刺激後の疾病行動における運動面の変化は見られなくなる [69]。したがって、疾病に関連する行動の減少は、覚醒システムの積極的な抑制と同時に起こる [76]。
この危険経路はまた、覚醒の調整に関与する脳幹の他の領域、たとえばセロトニン作動性の背側縫線核へも入力を提供し [68,69]、これにより、末梢の炎症と覚醒状態の変化によって調整または影響される脳機能との間の連結点として機能する可能性がある。
前述のとおり、臨床的うつ病と疾病行動は、主に炎症の役割を含む主要な経路の関与を共有している [15]。臨床的うつ病では、慢性かつ軽度の炎症過程および細胞性免疫(CMI)活性化の存在が確認されており、これはIFNγ関連経路の活性化を伴うTヘルパー1型(Th1)様応答によって特徴付けられる [77,78]。
最近のメタアナリシスおよび新たな研究報告により、特にIL-6、TNFα、およびIL-1の増加、ならびにCMIの活性化(たとえばネオプテリンおよび可溶性IL-2受容体[sIL-2R]のレベル上昇)といった、ヒトのうつ病における炎症性サイトカインの増加が確認されている [18–20,79,80]。ネオプテリンの増加は、IFNγを介したマクロファージ活性化の指標である。
ヒトにおいて、IFNαベースの免疫療法は、多くのC型肝炎ウイルス患者において身体症状およびうつ病様症状を誘発する。IFNαベースの免疫療法中のうつ症状の発症は、単球性サイトカイン、Th1型およびTh2型サイトカインの上昇を含むサイトカインネットワークの誘導と強く関連している [18,81,82]。
炎症性サイトカイン(PICs)および細胞性免疫(CMI)サイトカインの上昇は、うつ病様症状を引き起こす能力を有しており、サイトカインの投与はうつ病の急性期を再現する強力な実験モデルを提供する。げっ歯類における研究 [15] は、IL-1、IL-6、TNFα などのPICsおよび IL-2 や IFNγ などのCMIサイトカイン(いずれも約50 μg/kg)の投与が以下を誘発する強力な証拠を提供している:
a)疾病行動;
b)うつ病様症状(動機づけられた行動の喪失、社会的探索の減少、食欲不振、体重減少、自発的な運動活動の低下、運動の増加、記憶障害、空間記憶の障害、スコポラミンによる健忘効果の増強などを含む);
c)メランコリー症状(アネドニア:水と比較したショ糖またはチョコレートミルク溶液に対する嗜好の減少で示される、および視交叉上核を介した概日リズムへの影響を通じた変化を含む);
d)不安(高架十字迷路における不安誘発効果および条件づけられた恐怖記憶の増強を含む);
e)身体症状(疲労、痛覚過敏、自律神経症状などを含む)。
LPS の投与は、疾病行動だけでなく、うつ病様行動(社会的相互作用およびオープンフィールドテストでの活動の抑制、食物摂取と体重の減少、記憶機能障害)、不安様行動、身体的行動も誘発する [15]。
IL-1 のようなサイトカインは、強力な一次シグナル効果を持つだけでなく、セロトニンやノルアドレナリンといった気分の調整に密接に関与する多くの神経伝達物質も調節する [83]。最近では、炎症過程がうつ病の神経回路仮説と結び付けられている [84]。すなわち、PICs は報酬に基づく情動情報を処理し、主要なうつ病症状を担う皮質-線条体-辺縁系回路を調節する [84]。
確かに、LPS や他の炎症誘発因子による抑うつ誘発効果および不安誘発効果が本物であるのか、それとも疾病行動に関連しているのかを判断するのは難しい [85]。サイトカインやLPSを基盤としたモデルでは、うつ病様行動と疾病行動が共に観察されるため、これらのモデルのうち、急性のうつ病様行動を特徴とするものと疾病行動を特徴とするものを区別することはしばしば困難であった。
それでも、一部の研究グループは初期の疾病行動とその後のうつ病様行動を分離することに成功したようである。LPS誘発性のうつ病様行動と疾病行動の解離は、LPS投与後の異なる時間点でマウスをテストすることによって確立され得る [86]。Lacosta ら(1999)[87] は、マウスへのIL-2の全身投与が探索行動の減少およびモリス水迷路でのパフォーマンス低下を誘導することを示しており、これらは疾病行動とは関係がないことが示唆されている。脳室内(icv)IL-1β の投与は、(運動活動の減少、嗜眠、体重減少で示される)疾病行動反応と、ストレス様または不安様反応を誘導する [88]。
IRS(免疫-炎症反応系)の活性化は、炎症性メディエーターの産生やメディエーターが標的組織に及ぼす効果といった特定の制御点を標的とする調節機構によって、さまざまなレベルで制御されている [21,89]。このIRS応答の調節は、過度に活性化されたIRSを沈静化させるよう設計された反射的抑制を特徴とする、適応的かつ区画化された調節反応である [90]。炎症反射の抑制の例としては、炎症誘発によるIL-10(負の免疫調節性サイトカイン)の増加や、抗増殖因子であるトランスフォーミング成長因子(TGF)β の増加が挙げられる [21]。
神経経路におけるPICによる変化も急性炎症の抑制に関与しており、たとえば、グルココルチコイドおよびカテコールアミンの産生促進、コリン作動性経路の活性化などが含まれる [91]。たとえば、感染性(敗血症)および非感染性の全身性炎症反応症候群を制限するために、反作用的調節機構が開始される [90,92,93]。この反炎症反応症候群は、病原体や免疫的外傷によって引き起こされる過剰な炎症反応を抑制する、免疫状態の適応的反応である [90,92,93]。
臨床うつ病においても、特に反射的抑制といった類似の対抗的調節プロセスの存在が報告されている [11,78]。例えば、IL-1の機能を阻害するIL-1受容体拮抗因子(IL-1RA)の合成増加、PICによって誘導されるコルチゾール軸の活性化およびそれに伴うグルココルチコイドの免疫抑制的作用、IL-10、IL-1RAおよびグルココルチコイドの産生を増加させることで保護的に作用するIL-6産生の増加、リガンドと結合することで免疫細胞の増殖に必要なIL-2の利用可能量を制限し、IL-2欠乏状態を誘導するIL-2受容体(IL-2R)レベルの上昇、免疫抑制因子として機能するハプトグロビンなどの急性期タンパク質の産生増加、リンパ増殖反応を抑制する可能性のあるプロスタグランジン産生の増加、そして血漿トリプトファン濃度の低下(次節参照)などがある。
これらの「対抗性抗炎症反応症候群」のメカニズムは、臨床うつ病における免疫炎症反応が、ex vivoでのナチュラルキラー細胞活性の低下や、ミトゲン誘発性のリンパ増殖障害などの免疫抑制の兆候を伴う理由を説明するかもしれない [11]。敗血症/全身性炎症反応症候群に対する対抗的調節反応として典型的に用いられる「対抗性抗炎症反応症候群(counter anti-inflammatory response syndrome)」という用語にならって、我々はこの補償的反射システムを「補償的(抗)炎症反射システム(compensatory (anti)inflammatory reflex system: CIRS)」と呼ぶことを提案する。
疾病行動は、保護的な炎症反応(トリガーの除去を助け、エネルギーを炎症細胞へ再分配する)を支持し、炎症の潜在的有害作用(たとえばエネルギー不足)から保護すると同時に、抗炎症反射(カロリー制限や体重減少の抗炎症作用)の役割も果たす。したがって、疾病行動自体は急性炎症に対するCIRS反応とみなされるべきである。つまり、臨床うつ病が免疫炎症反応を抑制するCIRSを伴っているのに対し、疾病行動はCIRSの一部である。
TRYCAT(トリプトファン代謝産物)経路
最近、うつ病の一部の個体で炎症と関連する新たな経路、すなわちトリプトファン代謝産物(TRYCAT)経路の活性化が明らかになっている [94-97]。この経路の第一段階かつ律速酵素は、インドールアミン2,3-ジオキシゲナーゼ(IDO;EC 1.13.11.52)である [98]。IDOはIFNγやIL-1、TNFαなどのPICによって活性化され、トリプトファンの異化を促進し、トリプトファンの枯渇およびキヌレニン、キヌレン酸、キサントレン酸、キノリン酸などのTRYCATsの合成増加を引き起こす。
IDOは腎臓、肺、脾臓、十二指腸など多くの臓器、免疫細胞、およびアストログリアやミクログリアなど脳内にも発現している [99,100]。血漿中のトリプトファンの低下は臨床うつ病において頻繁に観察され、炎症のバイオマーカー(急性期反応物質、サイトカインレベルの上昇)やCMI活性化(血清ネオプテリンやsIL-2Rsの上昇)と強く関連している [94-96]。
IFNαを用いた免疫療法中にうつ病症状が発症する際、それはキヌレニン/トリプトファン比によって評価されるIDO活性化と強く関連している [101]。同様に、出生後の期間においても、トリプトファンの低下およびIDO活性の上昇は、不安およびうつ病症状と関連している [102]。急性のトリプトファン枯渇は、脆弱な個体においてうつ病症状の顕著な増加を引き起こす [103]。
最近の研究では、IDOの活性化がげっ歯類において疾病行動とうつ病様行動を分離する可能性が示されている [104]。すなわち、野生型(WT)マウスに弱毒化されたウシ型結核菌(BCG)を接種すると、IDOの活性化およびIFNγ、IL-1β、TNFαなどのPICおよびCMIサイトカインの増加が誘導される [104]。BCGの接種は、最初に急性の疾病行動エピソードを引き起こし、その後1週間後から慢性的なうつ病様症状の状態が続く。疾病行動はWTマウスおよびIFNγ受容体欠損(IFNγR(-/-))マウスの両方で同様に誘導される一方で、IFNγおよびTNFαは、ミクログリアにおけるIDO活性化とうつ病様行動の引き起こしに共に必要である。さらに、IDO欠損マウスはBCGによるうつ病誘発効果には抵抗性を示すが、BCG投与後の通常の炎症反応は示す [104]。
しかしながら、動物実験で得られたこれらのTRYCATデータは、臨床うつ病へと外挿するには困難が伴う。というのも、臨床における結果は議論の余地があるためである。すなわち、初期の研究では、うつ病患者におけるトリプトファン負荷後のキサントレン酸やキヌレニンといったTRYCATの尿中排泄には変化が見られなかった [105–108]。それにもかかわらず、キサントレン酸の高い排泄率は不安や血漿トリプトファンの可用性低下と関連していた [105,108]。これら後者の所見は、IDOの活性化による「TRYCATシャント」がうつ病患者における血漿トリプトファンを低下させていることを示している。
最近の研究では、うつ病においてキヌレン酸のレベルが低下し、その結果としてキヌレニン/キヌレン酸比が相対的に上昇していることが観察されている [109]。この比率は、うつ病の病態生理にとって重要である可能性がある。なぜなら、キヌレニンおよびその代謝産物のいくつか(例えばキノリン酸)は、うつ病誘発性、不安誘発性、興奮毒性および神経毒性を持つのに対し、キヌレン酸は神経保護的であるからである [96]。ある研究では、メランコリー型うつ病の青少年においてTRYCATの増加が示されており [110]、別の研究では、うつ病による自殺犠牲者のミクログリア内でキノリン酸の増加が示されている [111]。Subletteら [112] は、大うつ病を有する自殺企図者において血漿中キヌレニン濃度の上昇を検出した。
最近のデータは、TRYCAT経路の異常が従来うつ病の特徴とされてきたが、それが身体化(somatization)とより密接に関連している可能性を示しており、従来「心身症的症状(psychosomatic symptoms)」と呼ばれてきた症状は、「身体-身体的症状(physio-somatic symptoms)」と表現する方がより適切かもしれないことを示唆している [113]。
すなわち、うつ病、うつ病+身体化の併存、身体化単独、および健常対照とを比較した研究においては、血漿トリプトファンはうつ病よりも身体化においてより低く、キヌレニン/キヌレン酸比およびキヌレニン/トリプトファン比は、うつ病患者よりも身体化の患者で有意に高かった [113]。血漿トリプトファンは身体-身体的症状の重症度と負の相関を示し、両比率は正の相関を示した。
要約すると、急性炎症状態(例えばIFNαを用いた免疫療法中)においては、IDO活性化がうつ病様行動の発症と強く関連する一方で、臨床うつ病においては必ずしもそうではなく、身体-身体的症状や自殺行動を示す一部の個体においてのみTRYCATレベルの相対的上昇が見られる。
IDO活性化はCIRSの保護的機能を持っている。すなわち、IDOによる血漿トリプトファンの減少およびTRYCAT生成の増加は、例えばT細胞の活性化および増殖を抑制することにより、一次的な免疫炎症反応を弱める可能性がある [11,15]。この反射的抑制は、臨床うつ病の自然寛解に関与している可能性があり、うつ病が時に自己限定的疾患であるという観察と一致している [96]。
このCIRSメカニズムはまた、TRYCAT経路に関する矛盾した所見を説明するかもしれない。すなわち、急性うつ病状態(例えばIFNα誘発性うつ病)ではTRYCAT異常とうつ病発症の関連が強く見られるが、主要うつ病(DSM-IV-TR基準)ではこの関連ははるかに弱く、おそらくはトリプトファンの低下およびTRYCATの増加が初期の免疫炎症反応をすでに弱めてしまっているためである。
それにもかかわらず、前帯状皮質におけるキノリン酸のようなTRYCATの上昇は有害であり、臨床うつ病において役割を果たす可能性がある。
うつ病と疾病行動を区別する有害な免疫炎症性経路
共通の免疫炎症性経路が疾病行動とうつ病の基盤になっている可能性を示すいくつかの証拠はあるが、これらの経路は両者において異なる効果をもたらす。すなわち、疾病行動における炎症反応は、CIRSによる生体にとって有益な効果を持つが、うつ病、特に反復性および慢性のうつ病においては、炎症経路およびその後遺症は有害な効果を持つ。
感作と自己免疫への移行
再発性うつ病エピソードによって免疫炎症反応が感作されるという証拠がある。すなわち、細胞性免疫(CMI)活性化のバイオマーカーであるネオプテリンは、うつ病エピソードを2回以上経験した患者で、1回のみ経験した患者よりも有意に増加している [18,114]。同様に、血漿中のIL-1およびTNFαは、うつ病エピソードを3回以上経験した患者において有意に増加している [18]。うつ病の生涯歴を有する女性は、うつ病を経験したことのない女性と比較して、産褥初期においてIL-6およびsIL-1RAを含む炎症性バイオマーカーが増加している [115]。うつ病の男性におけるC反応性タンパク質(CRP)レベルの上昇は、現在のうつ病エピソードの重症度のみならず、再発性うつ病も予測する [116]。炎症性サイトカイン(PIC)が中枢感作を媒介すること、たとえば母子分離に対する行動反応などは、すでに知られている [117,118]。これは、再発性うつ病エピソードが抑うつ性サイトカインの病態生理学的反応を増幅し、炎症誘発性の行動反応を強化する可能性があることを示唆している。さらに、うつ病エピソードの回数が増加することが、再発および治療抵抗性のリスクを高めることが知られている [17]。このことから、免疫炎症経路の感作が新たなうつ病エピソードを発症する脆弱性を高めることが示唆される。
免疫炎症機構はまた、臨床的うつ病(54.1%)、メランコリア(82.9%)の患者における抗セロトニン(5-HT)抗体活性の高さ、対照群(5.7%)との比較においても説明可能である [119]。この5-HTに対する自己免疫活性は、炎症バイオマーカー(IL-1およびTNFαの上昇)およびCMI活性化(ネオプテリンの上昇)と有意に関連している。この点に関して、LPS、IFNγ、TNFαなどの炎症性およびCMI関連刺激の投与により、背側縫線核における5-HTニューロンの生存率が低下することが知られており、これはインドールアミン-2,3-ジオキシゲナーゼ(IDO)の活性化とは関連していない [120]。5-HTに対する自己免疫活性は、過去のうつ病エピソードの回数とも関連しており、過去のうつ病エピソードへの曝露が抗5-HT抗体活性を高め、これが新たなうつ病エピソード発症のリスクを高める可能性がある。
さらに、IL-6およびTNFαの上昇、ならびに血清亜鉛濃度の低下は、うつ病および治療抵抗性うつ病のリスクと関連している [121-125]。このことは、臨床的うつ病における免疫炎症反応が、治療抵抗性に対するリスクを高める可能性を示している [126]。また、免疫炎症過程が、単極性および双極性うつ病のみならず、躁病の病態生理学にも関与しているという証拠もある [127,128]。急性躁病は、sIL-6RおよびsIL-2Rレベルの上昇、急性期反応物質の増加 [127,128]、sCD4、sCD8、およびsIL-1Rアンタゴニストレベルの上昇 [129]、さらに総免疫グロブリン(Ig)G1、補体タンパクC3、C6、および因子Bの上昇を伴っている [130]。最近では、免疫炎症過程が双極性うつ病の進行に伴う各再発ごとの寛解間隔の短縮に関与していると議論されている [16,17]。
以上の知見は、うつ病および双極性障害の感作(キンドリング)および進行が、部分的には進行性の炎症、CMI、および自己免疫反応によって引き起こされることを示唆している。
O&NSプロセスによる損傷への移行
多くの炎症性疾患と同様に、臨床的うつ病は酸化ストレスおよびニトロ化ストレス(O&NS)経路の活性化を伴う [131]。これらの経路は、おそらくコエンザイムQ10、亜鉛、グルタチオンといった抗酸化物質のレベル低下や、うつ病における免疫炎症反応によって増幅され、抗酸化物質の減少、炎症、および活性化されたO&NS経路の間で悪循環を引き起こす [131]。O&NS経路が適応的な病的行動(sickness behavior)に関与しているかどうかについての報告はない。しかしながら、これらの経路は臨床的うつ病において有害な影響を及ぼし、さらに慢性うつ病にも関与している。うつ病が活性酸素種(ROS)および活性窒素種(RNS)の増加だけでなく、脂質、タンパク質、DNA、ミトコンドリアに対するO&NSによる損傷を特徴とすることを示す豊富な証拠が存在する [131]。
このような過程において、O&NS経路は膜脂肪酸および機能的タンパク質の化学構造を変化させる可能性がある。これらの変化を受けた脂肪酸およびタンパク質が免疫原性を持つようになると、それらの「新生エピトープ」に対して自己免疫反応が引き起こされ、これらのエピトープの機能や化学構造にさらに損傷を与える可能性がある [132,133]。多くのうつ病患者において、自己免疫反応がIgMを介して上昇しており、これは3種類のアンカレッジ分子(パルミチン酸、ミリスチン酸、L-ファルネシル-S-システイン)や、アセチルコリン、ホスファチジルイノシトール、オレイン酸、ならびにNO付加体(NO-トリプトファンおよびNO-チロシン)などの新生エピトープに向けられている [133]。これらの自己免疫反応は、細胞内シグナリング、アポトーシス、および細胞分化といった細胞機能に干渉する可能性がある。たとえば、アンカレッジ分子に向けられた自己免疫反応は、パルミトイル化、ミリストイル化、ファルネシル化といった過程、そしてそれにより膜への結合および数百種類のタンパク質の機能に干渉する可能性がある [133]。
これらのIgMを介する自己免疫反応の一部は、非慢性うつ病患者よりも慢性うつ病患者において有意に高くなっており、このO&NSによる損傷が、神経進行性経路を活性化することによって慢性うつ病を発症するリスクを高める可能性を示唆している [16,17,52,133]。これらのO&NS関連プロセスは、炎症性メディエーターが5-HTニューロンに及ぼす影響とあわせて、炎症およびCMI活性化からO&NSによる損傷と自己免疫反応への移行を説明するものであり、これらはいずれも既存の炎症を悪化させ、慢性うつ病の過程に関与していると考えられる。
神経進行性変化(ニューロプログレッション)への移行
臨床的うつ病において有害な影響を及ぼすが、病的行動(sickness behavior)には関与していないもう一つの免疫炎症関連経路は、神経進行性変化(ニューロプログレッション)である。これは、神経変性、神経新生および神経可塑性の低下、ならびにアポトーシスと関連する、段階的かつ潜在的に進行性のプロセスである [15,17,123,126,134-137]。多くの(ただしすべてではない)うつ病患者は、神経進行性疾患を示唆する特徴を呈する。上述のように、罹病期間が長く、より頻繁にうつ病エピソードを経験している人々は、その後の再発リスクが高い。治療反応は、より多くの再発性気分エピソードを経験するごとに低下する傾向がある [15,17,52]。
再発性うつ病エピソードは、認知機能障害の増加と相関しており、たとえば記憶力の低下は、各うつ病エピソードの後に2〜3%低下するとされている [138]。また、うつ病エピソードは認知症のリスク増加とも関連している [54]。同様に、より多くのうつ病エピソードは、脳の基礎的な構造変化、たとえば眼窩前頭皮質および帯状回下部前頭皮質、海馬、基底核の容積減少と関連している [52]。たとえば、罹病期間は大脳灰白質の容積と負の相関を示している [139]。メタアナリシスによると、慢性うつ病(2年以上)または再発性うつ病の患者では、海馬の容積が有意に減少しており、この減少はうつ病エピソードの回数と関連していることが示されている [140,141]。いくつかの研究では、再発性うつ病患者における海馬容積の減少が神経認知機能の低下と関連している [142]。
治療抵抗性および罹病期間は、右尾状核および左被殻の容積減少と関連している [52,143]。この効果は、特定の細胞型の細胞体サイズの縮小と部分的に関連している可能性がある [144]。また、うつ病において、上述の神経進行性変化が、少なくとも部分的には炎症およびO&NS経路によって引き起こされているという証拠がある [15,17,126]。IL-1やTNFαといった炎症性サイトカイン(PICs)、IFNγやIL-2などのCMIサイトカイン、キノリン酸などのTRYCATs、ならびに構造脂肪酸、アンカレッジ分子、機能的タンパク質、DNAおよびミトコンドリアに対するO&NSによる損傷は、すべて神経進行性変化に寄与している可能性がある [15,17,126]。
さらに、免疫刺激およびうつ病はともに、人間 [145-147] および齧歯類 [148] において、内臓感覚や情動の調整を処理する一連の脳領域に影響を与える。これらの領域には、内側前頭皮質(前帯状皮質)および基底前脳(側坐核)の一部が含まれる。興味深いことに、CIRS(補償性免疫制御系)は、病状の進行に伴って弱まるようであり、この炎症性活性化を抑制する機能の喪失が、複数回のエピソードで見られる神経進行性変化の過程に関与している可能性がある [149]。
以上の知見から、臨床的うつ病は、慢性的な炎症およびO&NS反応、あるいはその後遺症(感作、自己免疫、O&NSによる損傷、神経進行性変化)を伴うことが示されている。その結果、前節で述べられた炎症モデルは、PICsおよびCMIサイトカインが、進行性の経過と進行性の免疫炎症性病態生理を特徴とする臨床的うつ病をどのように引き起こすのかという機構的説明にはなっていない。しかしながら、これらの実験は、PICsおよびCMIサイトカインがうつ様行動の発症、および身体症状、メランコリア、不安といった症候群クラスターと関連しているという見解を支持している。ただし、LPSやサイトカイン誘導モデルの多くは、病的行動(sickness behavior)とうつ病を区別していなかった。また、これらの実験は、うつ病の症状次元のうち1〜2つの側面、たとえば、快感消失(アネドニア)およびそれに関連する甘味乳の摂取量低下といったモデルにのみ焦点を当てており、非常に限定的である [150]。
より適切な臨床的うつ病の動物モデルは、症状次元だけでなく、その典型的な経過(自然軽快型、増減型、進行型)、および進行性の病態生理(感作、酸化的損傷、自己免疫、神経進行性変化への移行)をも模倣できるように構築されるべきである。
うつ病と病的行動(sickness behavior)における病因的要因
病因的には、病的行動(sickness behavior)は、急性感染や炎症性外傷に応答して起こる、適応的な補償性免疫制御系(CIRS)の急性期として概念化されている [4,7,26]。しかしながら、解決段階(resolution phase)が誘導されなかった場合、たとえば免疫応答系(IRS)が病原体を排除できなかった場合には、CIRSが存在しているにもかかわらず炎症が持続し、慢性炎症状態を引き起こす可能性がある [21]。慢性炎症は、急性炎症の原因(例:化膿性細菌)の排除に失敗した場合、先天的に慢性的な刺激因子(例:真菌、サルコイドーシス)、または自己免疫反応によって生じることがある [151]。急性炎症と慢性炎症は、免疫応答のパターンおよび時間経過において区別される。急性炎症から慢性炎症への移行の時点は、エネルギー貯蔵が枯渇する時期とも関連しており、その時期はエネルギー貯蔵の性質によって異なるが、約19日から43日と推定されている [152]。この移行は、カヘキシア、インスリン抵抗性、貧血、骨減少症、高血圧など、いくつかの炎症性続発症と関係している [152]。
したがって、病的行動は、負のエネルギーバランスを補償し、活性化された免疫細胞へエネルギーを再配分することなどにより、急性の刺激因子による急性炎症から慢性炎症への移行を防ぐうえで重要な役割を果たしている [152]。一方で臨床的うつ病は、慢性的な炎症過程を伴っており、以下で説明されるように、その誘因は明確に定義されていない場合が多い。
多くの慢性疾患、たとえば変性疾患(糖尿病、動脈硬化など)や神経変性疾患(パーキンソン病など)においては、発症の引き金となる要因が明確に特定されておらず、慢性状態は慢性炎症とその病理過程を結びつける正のフィードバックループによって成り立っているように見える [21]。たとえば、パーキンソン病(PD)は、ミクログリア活性化とドーパミン作動性神経の変性の間で悪循環を形成しており、これは炎症性サイトカイン(PICs)や酸化および硝酸化ストレス(O&NS)などの有害な影響によって引き起こされている [25]。臨床的うつ病においても、同様のパターンが観察されており、慢性的な炎症過程が、進行性の自己免疫および神経進行性プロセスへの移行と関連しているようである。
病的行動とは対照的に、病原体は臨床的うつ病において主要な役割を果たしていない。ただし、一部の研究者は単純ヘルペスウイルス2型やトキソプラズマ・ゴンディイと精神病理との関連を試みている [153,154]。過去のレビューにおいて、我々は、急性感染やエプスタイン・バールウイルス(EBV)による感染が臨床的うつ病の発症に関連する誘因として作用するという良質な証拠は存在しないと結論づけた [155]。ただし、いくつかの種類の慢性感染は、臨床的うつ病と頻繁に関連しており、たとえばHIV感染 [156] やグラム陰性菌の腸管通過の増加などが挙げられる [157]。また、ライム病のような慢性感染は、顕著な神経精神医学的後遺症を引き起こすことがある [158,159]。
このように、病的行動が急性感染に対する適応的なCIRS応答である一方で、臨床的うつ病の発症には、わずかしか慢性病原性状態が関与していないようである。ただし、休眠状態にあった感染の再活性化や、それに続く感染誘導性の分子経路が、臨床的うつ病において重要な役割を果たしている可能性を排除することはできない。たとえば、脳内のウイルス感染は、実際には認識されているよりも頻繁に神経学的および精神的機能障害を引き起こす [160]。
うつ様行動を引き起こす複数の引き金要因が存在し、それには心理社会的ストレス因子、さまざまな医学的疾患、血液透析、インターフェロンα(IFNα)を用いた免疫療法、産後期などが含まれる [25,65,80]。人間における心理社会的ストレス因子は、脂質過酸化やDNA損傷などを含む炎症性、Th1様、O&NS応答を誘導する可能性があり、また、齧歯類では異なる種類のストレッサーが、末梢および中枢の炎症性、O&NS、神経進行性経路を活性化することが示されている [25,65,80,161]。たとえば、齧歯類において、社会的敗北ストレスは、LPSに対するミクログリアの反応性を高めることが知られており、社会的ストレス因子がミクログリアの応答調整に関与することが示唆されている [162]。
したがって、心理的外傷および心理社会的ストレス因子は、免疫炎症性、O&NS、神経進行性経路の活性化を通じて、うつ病およびうつ様行動を引き起こす可能性があると結論づけることができる。
免疫炎症性および酸化・硝酸化ストレス(O&NS)経路と関連する多くの異なる医学的疾患や状態は、うつ病との高い併存率を示す。
a) 慢性閉塞性肺疾患(COPD)、心血管疾患(CVD)、慢性疲労症候群、肥満およびメタボリックシンドローム、関節リウマチ(RA)、全身性エリテマトーデス(SLE)、炎症性腸疾患(IBD)、乾癬、骨粗鬆症、1型および2型糖尿病などの医学的疾患;
b) アルツハイマー病(AD)、パーキンソン病(PD)およびハンチントン病、多発性硬化症(MS)、脳卒中などの神経変性性または神経炎症性疾患;
c) 血液透析、インターフェロンα(IFNα)を用いた免疫療法、産後期などの状態 [25,163]。
我々は、これらの疾患/状態はすべて免疫炎症性およびO&NS経路の活性化を伴っており、したがって、共存するうつ病を引き起こし得る基本的な免疫/炎症状態を引き起こす可能性があると主張してきた [25]。同様に、これらと同じ経路は、気分がすぐれない、痛みや不快感、倦怠感などとして体験される病的行動(sickness behavior)を誘導する可能性もある。しかしながら、病的行動は定義上、適応的な反応であるのに対し、併存するうつ病は上述の医学的状態を悪化させる [25]。
併存するうつ病は、COPD、CVD、RA、SLE、IBD、乾癬、および1型・2型糖尿病の患者において生活の質を低下させ、障害や死亡率を上昇させる。併存するうつ病は、MS、PD、AD、脳卒中の患者においても生活の質を低下させ、神経学的欠損からの回復に悪影響を及ぼし、これらの神経疾患において罹患率および死亡率の上昇を予測する。これら併存うつ病による負の影響は、(神経)炎症負荷の増加、TRYCATの産生、O&NSによる損傷、自己免疫および神経進行性変化への移行によって説明され得る。これらすべてが、上述の医学的状態における(神経)炎症の進行を駆動する可能性がある。
IFNαを用いた免疫療法中においては、うつ病の発症率は治療12週目に最も高く、C型肝炎の患者の20%以上が中等度〜重度の抑うつ症状を呈していた [164]。倦怠感などの身体症状は治療開始の最初の週に増加し、その後数週間から数か月後に認知的・抑うつ的症状を予測した [165]。したがって、IFNαを用いた免疫療法は、病的行動を伴う急性炎症状態から、うつ病を伴う慢性炎症状態への移行を特徴とする、うつ病の引き金となり得る数少ない要因の1つである可能性がある。
病的行動とうつ病を区別するもう一つの要因は、前者が特定の免疫的トリガーに対する反応であるのに対し、うつ病を誘発する要因と抑うつとの関連は常に存在するとは限らないことである。たとえば、うつ病患者が反復性うつ病エピソードを経験するにつれて、うつ病が発現するためにストレス要因が必要である可能性は低くなる。過去に9回以上のエピソードを経験した後では、トリガーと抑うつの関連は弱まり、エピソードはトリガーとは無関係に自律的に出現するように見える [166]。この効果もまた、うつ病が進行性疾患であり、抑うつエピソードが感作されていくという知見によって説明され得る [17]。
以下の内容は、慢性軽度ストレスモデル(Chronic Mild Stress: CMS)や嗅球摘出ラットモデルなどの慢性動物モデルが、急性サイトカインまたはLPS誘導モデルよりも優れていることを示唆している。すなわち、
a)病的行動(sickness behavior)による“汚染”が少なく、
b)臨床的うつ病の心理社会的病因、(神経)炎症性および(神経)進行性病態生理をより正確に反映している、という点である。
したがって、げっ歯類における慢性軽度ストレスモデルは、心理社会的なトリガーが、全身性および中枢神経系の炎症、神経新生の低下および神経細胞の損傷を含む神経進行性変化と関連して、うつ様行動を引き起こす可能性があることを示している [65]。
また、慢性軽度ストレスモデルは、TRYCAT経路の中枢神経系内の部位による異なる制御によってその効果の一部を媒介している [167]。慢性軽度ストレス後の扁桃体および線条体におけるキノリン酸の選択的増加と、前頭皮質におけるキヌレニン酸の増加傾向は、心理社会的ストレスに関連した変化を媒介するうえでTRYCAT経路の可変的活性化が重要な役割を果たすことを示唆している。
このような中枢神経系内でのTRYCAT経路の部位特異的活性化は、病的行動と臨床的うつ病を識別するうえで意味を持つ可能性がある。
また、嗅球摘出ラットモデルは、臨床的うつ病で観察される(神経)炎症性および神経進行性の現象を反映している [66,67,168,169]。
長期化、過剰、または不適応な病的行動はうつ病なのか?
近年では、「長期化した」「過剰な」および「不適応な」病的行動といった新たな概念が文献で記述されている [170,171]。
トランスレーショナルモデルにおいては、過剰な炎症および神経免疫応答が、「長期化した」病的行動、たとえば記憶障害などと関連づけられている。こうした過剰な反応は、成体マウスと比較して老齢マウスにおいて顕著に観察される [170]。この年齢依存的な長期化病的行動は、ミクログリアにおけるミトコンドリアDNA(mtDNA)の酸化損傷、細胞内ROSの増加、NF-κBの活性化と関連している [170]。
IL-1βの亜慢性投与は、空間記憶および学習記憶を有意に障害し、これは神経栄養因子およびその受容体の機能障害と相関していた [172]。さらに、アセチルコリンなどの神経伝達物質の放出は、記憶想起時において有意に低下していた。海馬ニューロンにおいては、IL-1βの投与が細胞アポトーシスを有意に誘導し、AMPA受容体(α-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸受容体)を減少させ、NMDA(N-メチル-D-アスパラギン酸)受容体の変化を増加させており、これはアルツハイマー病で観察される変化に類似している [173]。
したがって、うつ病が「長期化した病的行動」による不適応な症候群であるという見方は妥当ではなく、むしろ慢性的な基礎免疫炎症性および変性プロセスの結果であると考えられる。
これらの知見はまた、急性に誘発された炎症に対して解決が生じず、その結果として慢性炎症性病態への移行が起こったことを示している。推論的に言えば、この状態を「長期化した病的行動」とは呼べない。なぜなら、「長期化した病的行動」という語は、本来炎症性外傷に対する短期間の適応的反応を意味するからである。
それにもかかわらず、共通する経路、たとえば炎症性サイトカイン(PIC)の増加などは、病的行動とうつ病の症状の一部が重なる現象を説明する妥当な結論である。
うつ病を、感染からの防御と関連づけて病的行動の進化的産物とする新たな仮説もある。このような見方では、うつ病は病原体と戦い、新たな病原体への曝露を避けるために免疫系を助ける進化的な行動反応と考えられている [26,174,175]。しかしながら、これらの仮説は、臨床的うつ病が単なる行動的反応ではなく、連鎖的な神経生物学によって駆動される進行性の疾患であり、進行性の経過および病態生理を伴うという事実を考慮していない。
急性の無気力、痛覚過敏、興味喪失、不安、快感喪失などは有益な行動であるが、それが慢性化した場合、同じ症状は一般に有益ではなく、病理的かつ不適応的なものとなる。これらの症状は、うつ病患者をさらに社会的接触から孤立させ、無気力や士気喪失、未来に対する否定的な予測を生み出す可能性がある [26]。さらに、慢性疾患は、患者が障害の結果に適応するための対処および適応戦略を必要とする。うつ病の性質に関する信念や対処スタイルには多様性があり、それらの中には適応的なものもあれば、不適応的なものもある [176]。
抗うつ治療
抗うつ薬は、正常な被験者および動物モデルにおいて、有意な免疫調節および免疫抑制作用を示す。三環系抗うつ薬(TCA)および選択的セロトニン再取り込み阻害薬(SSRI)は、IL-1β、TNFα、IL-6などの炎症性サイトカイン(PIC)や、IL-2やIFNγなどのTh1様サイトカインの産生を抑制する [177]。
ほとんどの抗うつ薬、すなわちTCA、SSRI、可逆的モノアミン酸化酵素A阻害薬、セロトニンおよびノルアドレナリン再取り込み阻害薬、および非定型抗うつ薬(例えば、チアネプチン)はすべて、免疫抑制性サイトカインであるIL-10の産生を増加させるか、IFNγの産生を低下させ、結果としてIFNγ/IL-10の産生比率を減少させる [178]。
SSRIおよびTCAは、脳細胞培養においてもIL-1β、TNFα、IL-6の産生を抑制することが示されている [65]。また、動物モデルでは抗うつ薬が抗炎症効果を示す [65]。致死量のLPSを投与されたマウスは、ブプロピオンの投与によって保護され、IFNγ、TNFα、IL-1βの産生が有意に減少する [179]。また、抗うつ薬は炎症誘発性の病的行動を軽減する可能性があることも示唆されている。例えば、チアネプチンは末梢(ただし中枢ではない)投与によって誘発されたLPSおよびIL-1βによる病的行動を軽減する可能性がある [180]。TNFαの機能を阻害するエタネルセプトなど、炎症を標的とした治療もIL-1β誘発性の病的行動を軽減する可能性がある [181]。
一方、うつ病患者においては、抗うつ薬のin vivoでの効果はそれほど明確ではない。抗うつ薬の亜慢性投与は、うつ病患者の炎症兆候を一貫して軽減するわけではない [182,183]。これに関連して、最近のメタアナリシスでは、SSRI以外の抗うつ薬のサブクラスは、炎症性サイトカインの濃度を軽減しないことが示されている [184]。
したがって、炎症、Th1機能の抑制、Tレグ(制御性T細胞)機能の促進を標的とした抗うつ薬の免疫調節効果は広く確認されているにもかかわらず、うつ病における臨床的寛解は、免疫炎症性経路の正常化とは一致しない [182–184]。
このことから、臨床的うつ病は抗うつ薬の免疫抑制効果に対する“抵抗性”を伴っているように見受けられる [183]。これは、免疫炎症性経路が抗うつ薬では抑制できないプロセス、例えばネオ抗原決定基に対する自己免疫応答 [133] やグラム陰性菌の腸管からの移行亢進 [157] によって持続的に活性化されている可能性を示唆する。
さらに、抗うつ薬は酸化ストレスおよび窒素種(O&NS)の軽減、抗酸化物質の増加、神経進行性プロセスの抑制にも影響を与えることが示されている [183]。しかし、免疫炎症経路、O&NS経路、自己免疫応答および神経進行性の亢進および感作は、うつ病のステージング、例えば治療抵抗性や再発などに部分的に寄与する。したがって、これらの経路は、多くの臨床試験で抗うつ薬の有効性がプラセボを上回らない理由や [185]、抗うつ薬で治療されたにもかかわらず高い再発率が認められる理由を部分的に説明できる [186]。
そのため、現在では炎症、Th1活性化、O&NS、抗酸化物質の低下、神経進行性変化を標的とする薬剤を用いた、新たな併用治療戦略が臨床的うつ病に対して開発されつつある。これには、スタチン、アセチルサリチル酸(アスピリン)、ミノサイクリン、亜鉛、N-アセチルシステイン、クルクミン、ω3系多価不飽和脂肪酸などが含まれる [183]。
ーーーーー
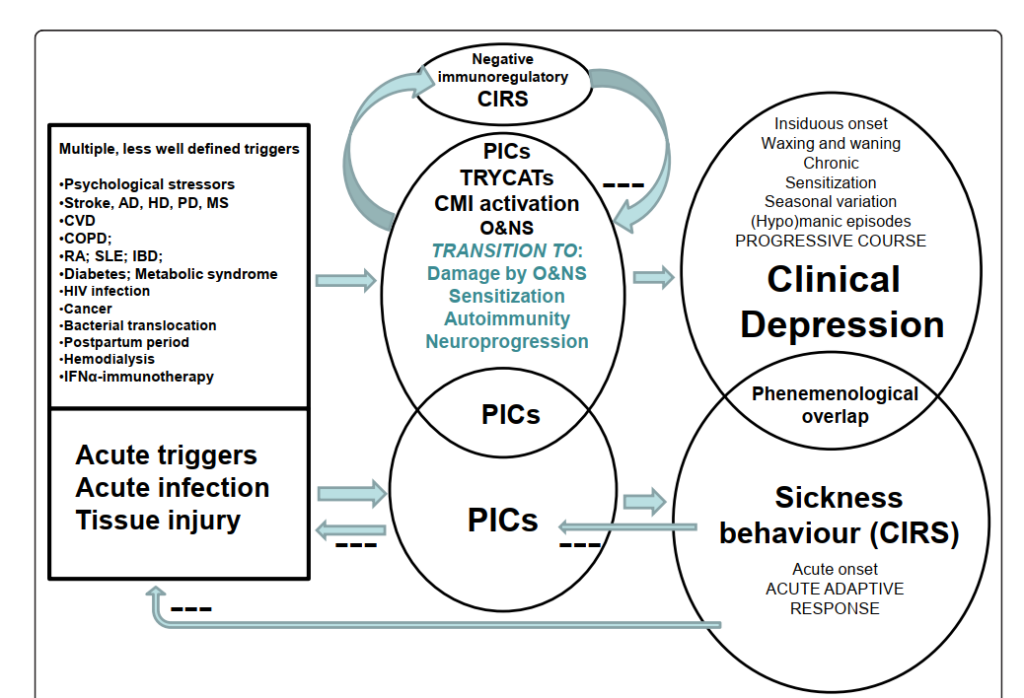
以下は、提供された文章の逐語的かつ正確な日本語訳です:
図3 この図は、疾病行動と臨床的うつ病を比較したものである。
疾病行動はエネルギーを節約し、トリガーの除去を助け、抗炎症作用を有し、そのため回復を促進し、代償的(抗)炎症反射系(CIRS)の一部である。
炎症性サイトカイン(PICs)の増加は、疾病行動とうつ病の両方の根底にあり、それによって部分的な現象学的重なりが説明できる可能性がある。
しかしながら、うつ病は特有の経過および病態生理を伴う慢性疾患であり、一次的な炎症反応を抑制するCIRSの存在が認められる。
トリプトファン代謝物(TRYCATs)、細胞性免疫(CMI)活性化、および酸化・ニトロ酸化ストレス(O&NS)の異常、とりわけそれらの後遺症(O&NSによる損傷、感作、自己免疫および神経進行)は、うつ病の特異的な有機的基盤である。
疾病行動が急性のトリガーに対する行動的反応である一方で、うつ病の発症は、より多様で明確に定義されていない複数のトリガー因子に関連しており、例えば、以下のような脳疾患:アルツハイマー病(AD)、ハンチントン病(HD)、パーキンソン病(PD)、脳卒中および多発性硬化症(MS);全身性疾患:心血管疾患(CVD)、慢性閉塞性肺疾患(COPD)、関節リウマチ(RA)、全身性エリテマトーデス(SLE)、炎症性腸疾患(IBD)、糖尿病、メタボリックシンドローム、HIV感染、がん、細菌の経腸移行;および以下のような状態:産後期間、血液透析、インターフェロン(IFN)αを用いた免疫療法、などがある。
ーーーーー
結論
図3は、病的行動と臨床的うつ病を比較している。病的行動は引き金となる要因を排除し、抗炎症作用を持ち、エネルギーを節約する。したがって、病的行動は回復を促進し、急性の引き金に対する過剰な免疫炎症反応を制限するCIRS(補償性免疫調節システム)の一部と見なされるべきである。
横断的には、病的行動とうつ病の基本症状やメランコリア的症状、身体症状、そして不安症状の側面との間に現象学的な類似点が存在する。しかし、主要な違いは、病的行動の中核症状である全身倦怠感が、うつ病患者の一部にしか見られない点であり、また発熱のような顕著な症状は病的行動に特有である。さらに、うつ病はしばしば食欲不振や体重減少ではなく、過食や体重増加を伴う。
ほとんどの個人にとって、うつ病は再発傾向(増悪と軽快)、慢性経過、季節変動、時には(軽)躁症状を伴う一生続く疾患である。さらに、感作および潜在的に進行性の悪化パターンがうつ病の経過を特徴づける。これは、19~43日間続く急性で短期間の行動パターンとして定義される病的行動とは対照的である。
翻訳研究では、炎症経路が病的行動とうつ病の両方に関与することが示されており、両者の部分的な現象学的重なりを説明できる可能性がある。臨床的うつ病には、一次的免疫炎症反応を抑制するCIRSが伴い、炎症およびROS/RNS(活性酸素種/活性窒素種)過剰産生から、炎症および細胞性免疫(CMI)応答の感作、進行性のO&NS(酸化・窒素ストレス)による損傷、自己免疫反応への移行が生じる。これら後者の経路は、神経進行性プロセスの基盤となっており、複数のうつ病エピソードが神経組織の損傷とその機能的および認知的後遺症を引き起こす。
病的行動も免疫炎症経路によって誘発されるが、臨床的うつ病とは異なり、病的行動複合体は一次的な引き金からの回復を促進する有益なCIRS効果を持つ。急性炎症期が19~43日以内に解決しない場合、慢性炎症が続発し、慢性炎症性病理への移行が生じる可能性がある。病的行動はこの移行を防ぐうえで重要な役割を果たし、エネルギーの負のバランスを補い、活性化された免疫細胞へとエネルギーを再配分する。
急性感染は通常、病的行動を引き起こすが、臨床的うつ病において急性感染が主要な役割を果たすという証拠はほとんどない。トラウマ的な人生経験は炎症状態を誘発し、しばしば臨床的うつ病へと至るが、心理社会的ストレス因子とうつ病的病的行動との関連性は報告されていない。(自己)免疫疾患や(神経)炎症性疾患の患者では、併発するうつ病が罹患率および死亡率を上昇させる一方、病的行動が存在する場合には、炎症経路を抑制する傾向がある。
総じて、病的行動は有益なCIRS応答であるのに対し、臨床的うつ病は機能障害を伴う進行性疾患である。炎症は“ヤヌスの顔”を持つ反応を引き起こす。すなわち、一方ではCIRS応答(病的行動など)を含む良性の“急性”保護性炎症応答であり、他方では(神経)炎症および(神経)変性過程との間に正のフィードバックループが形成されることによって臨床的うつ病という慢性的な障害に至る“悪性”の“慢性”側面である。
このヤヌスの顔はまた、進化の過程で保存されてきた炎症誘導性の適応的行動応答が、現代の工業化社会において有病率が増加している炎症関連の慢性進行性疾患へと移行していく過程を表している [187]。
略語一覧
AD:アルツハイマー病(Alzheimer disease)
BCG:カルメット・ゲラン桿菌(bacille Calmette-Guérin)
CMI:細胞性免疫(cell-mediated immune)
COPD:慢性閉塞性肺疾患(chronic obstructive pulmonary disease)
CRP:C反応性タンパク(C-reactive protein)
CVD:心血管疾患(cardiovascular disorder)
DSM IV TR:精神障害の診断と統計マニュアル第4版・テキスト改訂版(The Diagnostic and Statistical Manual of Mental Disorders, fourth edition, text revision)
IBD:炎症性腸疾患(inflammatory bowel disease)
IDO:インドールアミン2,3-ジオキシゲナーゼ(indoleamine 2,3-dioxygenase)
IFN:インターフェロン(interferon)
IL-1:インターロイキン-1(interleukin-1)
IL-1RA:IL-1受容体拮抗因子(IL-1 receptor antagonist)
IRS:炎症反応システム(inflammatory responses system)
LPS:リポポリサッカライド(lipopolysaccharide)
mtDNA:ミトコンドリアDNA(mitochondrial DNA)
O&NS:酸化および窒素ストレス(oxidative and nitrosative stress)
PD:パーキンソン病(Parkinson disease)
PICs:炎症性サイトカイン(pro-inflammatory cytokines)
RA:関節リウマチ(rheumatoid arthritis)
ROS/RNS:活性酸素種および活性窒素種(reactive oxygen and nitrogen species)
sIL-2R:可溶性IL-2受容体(soluble IL-2 receptor)
SLE:全身性エリテマトーデス(systemic lupus erythematosus)
SSRIs:選択的セロトニン再取り込み阻害薬(selective 5-HT reuptake inhibitors)
TCAs:三環系抗うつ薬(tricyclic antidepressants)
TNF:腫瘍壊死因子(tumor necrosis factor)
TGF:形質転換成長因子(transforming growth factor)
Th:Tヘルパー(T helper)
TRYCAT:トリプトファン代謝物(tryptophan catabolite)
謝辞
著者らは、本文について広範な議論を行ってくれたBruce Charltonに感謝の意を表します。
著者情報
1:Maes Clinics @ TRIA、ピヤバテ病院、998 Rimklongsamsen Road、バンコク10310、タイ
2:ディーキン大学医学部、Kitchener House、Ryrie Street、ジーロング、ビクトリア州3220、オーストラリア
3:Orygen青少年メンタルヘルス研究センター、若者メンタルヘルスセンター、35 Poplar Road、パークビル、ビクトリア州3052、オーストラリア
4:ビクトリア州メンタルヘルス研究所、Kenneth Myer Building、30 Royal Parade、パークビル、ビクトリア州3052、オーストラリア
5:メルボルン大学精神医学科、Royal Melbourne Hospital本館北ブロック1階、パークビル、ビクトリア州3050、オーストラリア
6:バージニア大学看護学部補完代替医療研究センター、PO Box 800793、シャーロッツビル、VA22908、アメリカ合衆国
7:ダルハウジー大学心理学および神経科学学科、1355 Oxford Street、ハリファックス、B3H 4R2、カナダ
8:中国西南絶滅危惧薬用資源開発工学研究所・中国工程院薬理学部、広西自治区南寧市興寧区長崗路189号、郵便番号30023、中華人民共和国
9:CRC、57 Laurel Street、グラスゴーG11 7QT、スコットランド、イギリス
10:ウッチ医科大学成人精神医学科、Aleksandrowska 159、ウッチ、91-229、ポーランド
11:ゴールウェイ大学薬理学部、University Road、ゴールウェイ、アイルランド
著者の貢献
MMとMBが本レビューの設計に関与し、すべての著者が原稿の作成に貢献した。すべての著者は本稿に均等に貢献し、最終原稿を読み、承認した。
利益相反
本研究に対する特定の財政的支援はなかった。
MBkは、NIH、共同研究センター、サイモンズ自閉症財団、ビクトリアがん協会、スタンレー医学研究財団、MBF、NHMRC、Beyond Blue、ジーロング医学研究財団、ブリストル・マイヤーズ スクイブ、イーライリリー、グラクソ・スミスクライン、オルガノン、ノバルティス、メインファーマ、セルヴィエから研究助成金・支援を受けたことがあり、またアストラゼネカ、ブリストル・マイヤーズ スクイブ、イーライリリー、グラクソ・スミスクライン、ヤンセン・シラーグ、ルンドベック、メルク、ファイザー、サノフィ・サンテラボ、セルヴィエ、ソルベイ、ワイスで講演を行っており、さらに同様の企業のコンサルタントも務めている。その他の著者には利益相反はない。
**受理日:**2012年4月23日
**受理確定日:**2012年6月29日
**公開日:**2012年6月29日
References
- Maes M: A review on the acute phase response in major depression. Rev
Neurosci 1993, 4:407-416. - Maes M, Meltzer HY, Scharpe S, Cooreman W, Uyttenbroeck W, Suy E,
Vandervorst C, Calabrese J, Raus J, Cosyns P: Psychomotor retardation,
anorexia, weight loss, sleep disturbances, and loss of energy:
psychopathological correlates of hyperhaptoglobinemia during major
depression. Psychiatry Res 1993, 47:229-241. - Holmes JE, Miller NE: Effects of bacterial endotoxin on water intake, food
intake, and body temperature in the albino rat. J Exp Med 1963,
118:649-658. - Hart BL: Biological basis of the behavior of sick animals. Neurosci Biobehav
Rev 1988, 12:123-137. - Maier SF, Wiertelak EP, Martin D, Watkins LR: Interleukin-1 mediates the
behavioral hyperalgesia produced by lithium chloride and endotoxin.
Brain Res 1993, 623:321-324. - Yirmiya R: Endotoxin produces a depressive-like episode in rats. Brain Res
1996, 711:163-174. - Johnson RW: The concept of sickness behavior: a brief chronological
account of four key discoveries. Vet Immunol Immunopathol 2002,
87:443-450. - Qin L, Wu X, Block ML, Liu Y, Breese GR, Hong JS, Knapp DJ, Crews FT:
Systemic LPS causes chronic neuroinflammation and progressive
neurodegeneration. Glia 2007, 55:453-462. - Dantzer R, O’Connor JC, Freund GG, Johnson RW, Kelley KW: From
inflammation to sickness and depression: when the immune system
subjugates the brain. Nat Rev Neurosci 2008, 9:46-56. - Burton MD, Sparkman NL, Johnson RW: Inhibition of interleukin-6 transsignaling in the brain facilitates recovery from lipopolysaccharideinduced sickness behavior. J Neuroinflammation 2011, 8:54.
- Maes M: Evidence for an immune response in major depression: a
review and hypothesis. Prog Neuropsychopharmacol Biol Psychiatry 1995,
19:11-38. - Maes M, Bosmans E, Suy E, Vandervorst C, DeJonckheere C, Raus J:
Depression-related disturbances in mitogen-induced lymphocyte
responses and interleukin-1 beta and soluble interleukin-2 receptor
production. Acta Psychiatr Scand 1991, 84:379-386. - Maes M, Scharpe S, Bosmans E, Vandewoude M, Suy E, Uyttenbroeck W,
Cooreman W, Vandervorst C, Raus J: Disturbances in acute phase plasma
proteins during melancholia: additional evidence for the presence of an
inflammatory process during that illness. Prog Neuropsychopharmacol Biol
Psychiatry 1992, 16:501-515. - Song C, Dinan T, Leonard BE: Changes in immunoglobulin, complement
and acute phase protein levels in the depressed patients and normal
controls. J Affect Disord 1994, 30:283-288. - Leonard B, Maes M: Mechanistic explanations how cell-mediated immune
activation, inflammation and oxidative and nitrosative stress pathways
and their sequels and concomitants play a role in the pathophysiology
of unipolar depression. Neurosci Biobehav Rev 2012, 36:764-785. - Berk M, Brnabic A, Dodd S, Kelin K, Tohen M, Malhi GS, Berk L, Conus P,
McGorry PD: Does stage of illness impact treatment response in bipolar
disorder? Empirical treatment data and their implication for the staging
model and early intervention. Bipolar Disord 2011, 13:87-98. - Berk M, Kapczinski F, Andreazza AC, Dean OM, Giorlando F, Maes M,
Yücel M, Gama CS, Dodd S, Dean B, Magalhaes PV, Amminger P, McGorry P,
Malhi GS: Pathways underlying neuroprogression in bipolar disorder:
focus on inflammation, oxidative stress and neurotrophic factors.
Neurosci Biobehav Rev 2011, 35:804-817. - Maes M, Mihaylova I, Kubera M, Ringel K: Activation of cell-mediated
immunity in depression: association with inflammation, melancholia,
clinical staging and the fatigue and somatic symptom cluster of
depression. Prog Neuropsychopharmacol Biol Psychiatry 2012, 36:169-175. - Dowlati Y, Herrmann N, Swardfager W, Liu H, Sham L, Reim EK, Lanctôt KL:
A meta-analysis of cytokines in major depression. Biol Psychiatry 2010,
67:446-457. - Liu Y, Ho RC, Mak A: Interleukin (IL)-6, tumour necrosis factor alpha (TNF-
αa) and soluble interleukin-2 receptors (sIL-2R) are elevated in patients
with major depressive disorder: a meta-analysis and meta-regression. J
Affect Disord 2012, 139:230-239. - Medzhitov R: Inflammation 2010: new adventures of an old flame. Cell
2010, 140:771-776. - Peters A: The energy request of inflammation. Endocrinology 2006,
147:4550-4552. - Steinberg GR, Watt MJ, Febbraio MA: Cytokine regulation of AMPK
signalling. Front Biosci 2009, 14:1902-1916. - Roubenoff R, Roubenoff RA, Cannon JG, Kehayias JJ, Zhuang H, DawsonHughes B, Dinarello CA, Rosenberg IH: Rheumatoid cachexia: cytokinedriven hypermetabolism accompanying reduced body cell mass in
chronic inflammation. J Clin Invest 1994, 93:2379-2386. - Maes M, Kubera M, Obuchowiczwa E, Goehler L, Brzeszcz J: Depression’s
multiple comorbidities explained by (neuro)inflammatory and oxidative
& nitrosative stress pathways. Neuro Endocrinol Lett 2011, 32:7-24. - Charlton BG: The malaise theory of depression: major depressive
disorder is sickness behavior and antidepressants are analgesic. Med
Hypotheses 2000, 54:126-30. - Cunningham-Rundles S, McNeeley DF, Moon A: Mechanisms of nutrient
modulation of the immune response. J Allergy Clin Immunol 2005,
115:1119-1128. - Kluger MJ: Fever. Pediatrics 1980, 66:720-724.
- Schaffner A: Fever–useful or noxious symptom that should be treated?
Ther Umsch 2006, 63:185-188. - Rantala S, Vuopio-Varkila J, Vuento R, Huhtala H, Syrjänen J: Predictors of
mortality in beta-hemolytic streptococcal bacteremia: a populationbased study. J Infect 2009, 58:266-272. - El-Radhi AS: The role of fever in the past and present. Med J Islamic World
Acad Sci 2011, 19:9-14. - Harden LM, du Plessis I, Roth J, Loram LC, Poole S, Laburn HP: Differences
in the relative involvement of peripherally released interleukin (IL)-6,
brain IL-1β and prostanoids in mediating lipopolysaccharide-induced
fever and sickness behavior. Psychoneuroendocrinology 2011, 36:608-622. - Lennie TA: Relationship of body energy status to inflammation-induced
anorexia and weight loss. Physiol Behav 1998, 64:475-481. - Kluger MJ, Rothenburg BA: Fever and reduced iron: their interaction as a
host defense response to bacterial infection. Science 1979, 203:374-376. - Jung KJ, Lee EK, Kim JY, Zou Y, Sung B, Heo HS, Kim MK, Lee J, Kim ND,
Yu BP, Chung HY: Effect of short term calorie restriction on proinflammatory NF-kB and AP-1 in aged rat kidney. Inflamm Res 2009,
58:143-150. - MacDonald L, Radler M, Paolini AG, Kent S: Calorie restriction attenuates
LPS-induced sickness behavior and shifts hypothalamic signaling
pathways to an anti-inflammatory bias. Am J Physiol Regul Integr Comp
Physiol 2011, 301:R172-184. - Bosutti A, Malaponte G, Zanetti M, Castellino P, Heer M, Guarnieri G,
Biolo G: Calorie restriction modulates inactivity-induced changes in the
inflammatory markers C-reactive protein and pentraxin-3. J Clin
Endocrinol Metab 2008, 93:3226-3229. - Kopp HP, Kopp CW, Festa A, Krzyzanowska K, Kriwanek S, Minar E, Roka R,
Schernthaner G: Impact of weight loss on inflammatory proteins and
their association with the insulin resistance syndrome in morbidly obese
patients. Arterioscler Thromb Vasc Biol 2003, 23:1042-1047. - Jellema A, Plat J, Mensink RP: Weight reduction, but not a moderate
intake of fish oil, lowers concentrations of inflammatory markers and
PAI-1 antigen in obese men during the fasting and postprandial state.
Eur J Clin Invest 2004, 34:766-773. - Sharman MJ, Volek JS: Weight loss leads to reductions in inflammatory
biomarkers after a very-low-carbohydrate diet and a low-fat diet in
overweight men. Clin Sci (Lond) 2004, 107:365-369. - Yang WS, Lee WJ, Funahashi T, Tanaka S, Matsuzawa Y, Chao CL, Chen CL,
Tai TY, Chuang LM: Weight reduction increases plasma levels of an
adipose-derived anti-inflammatory protein, adiponectin. J Clin Endocrinol
Metab 2002, 86:3815-3819. - Maes M, Maes L, Schotte C, Vandewoude M, Martin M, D’Hondt P, Blockx P,
Scharpé S, Cosyns P: Clinical subtypes of unipolar depression: part III.
quantitative differences in various biological markers between the
cluster-analytically generated nonvital and vital depression classes.
Psychiatry Res 1990, 34:59-75. - Maes M, Meltzer HY, Cosyns P, Schotte C: Evidence for the existence of
major depression with and without anxiety features. Psychopathology
1994, 27:1-13. - Maes M: “Functional” or “psychosomatic” symptoms, for example a flulike malaise, aches and pain and fatigue, are major features of major
and in particular of melancholic depression. Neuro Endocrinol Lett 2009,
30:564-573. - Rausch JL, Johnson ME, Corley KM, Hobby HM, Shendarkar N, Fei Y,
Ganapathy V, Leibach FH: Depressed patients have higher body
temperature: 5-HT transporter long promoter region effects.
Neuropsychobiology 2003, 47:120-127. - Szuba MP, Guze BH, Baxter LR Jr: Electroconvulsive therapy increases
circadian amplitude and lowers core body temperature in depressed
subjects. Biol Psychiatry 1997, 42:1130-1137. - Boland RJ, Keller MB: The course of depression. In
Neuropsychopharmacology, the 5th Generation of Progress. Edited by: Davis
KL, Charney D, Coyle JT, Nemeroff C. New York: American College of
Neuropsychopharmacology; 2002:1009-1015. - Berk M, Conus P, Lucas N, Hallam K, Malhi GS, Dodd S, Yatham LN, Yung A,
McGorry P: Setting the stage: from prodrome to treatment resistance in
bipolar disorder. Bipolar Disord 2007, 9:671-678. - Berk M, Hallam KT, McGorry PD: The potential utility of a staging model
as a course specifier: a bipolar disorder perspective. J Affect Disord 2007,
100:279-281. - Berlim MT, Turecki G: What is the meaning of treatment resistant/
refractory major depression (TRD)? A systematic review of current
randomized trials. Eur Neuropsychopharmacol 2007, 17:696-707. - Caliyurt O, Altiay G: Resting energy expenditure in manic episode. Bipolar
Disord 2009, 11:102-106. - Moylan S, Maes M, Wray NR, Berk M: The neuroprogressive nature of
Major Depressive Disorder: pathways to disease evolution and
resistance, and therapeutic implications. Mol Psychiatry . - Kessing LV: Severity of depressive episodes during the course of
depressive disorder. Brit J Psychiatry 2008, 192:290-293. - Kessing LV, Andersen PK: Does the risk of developing dementia increase
with the number of episodes in patients with depressive disorder and in
patients with bipolar disorder? J Neurol Neurosurg Psychiatry 2004,
75:1662-1666. - Post RM, Rubinow DR, Ballenger JC: Conditioning and sensitisation in the
longitudinal course of affective illness. Br J Psychiatry 1986, 149:191-201. - Antelman SM, Levine J, Gershon S: Time-dependent sensitization: the
odyssey of a scientific heresy from the laboratory to the door of the
clinic. Mol Psychiatry 2000, 5:350-356. - Bell IR, Hardin EE, Baldwin CM, Schwartz GE: Increased limbic system
symptomatology and sensitizability of young adults with chemical and
noise sensitivities. Environ Res 1995, 70:84-97. - Kapczinski F, Vieta E, Andreazza AC, Frey BN, Gomes FA, Tramontina J,
Kauer-Sant’anna M, Grassi-Oliveira R, Post RM: Allostatic load in bipolar
disorder: implications for pathophysiology and treatment. Neurosci
Biobehav Rev 2008, 32:675-692. - Sato T, Bottlender R, Sievers M, Möller HJ: Distinct seasonality of
depressive episodes differentiates unipolar depressive patients with and
without depressive mixed states. J Affect Disord 2006, 90:1-5. - Sylvén SM, Papadopoulos FC, Olovsson M, Ekselius L, Poromaa IS,
Skalkidou A: Seasonality patterns in postpartum depression. Am J Obstet
Gynecol 2011, 204:413.e1-6. - Maes M, Cosyns P, Meltzer HY, De Meyer F, Peeters D: Seasonality in
violent suicide but not in nonviolent suicide or homicide. Am J Psychiatry
1993, 150:1380-1385. - Stone EA, Lehmann ML, Lin Y, Quartermain D: Depressive behavior in
mice due to immune stimulation is accompanied by reduced neural
activity in brain regions involved in positively motivated behavior. Biol
Psychiatry 2006, 60:803-811. - Gaykema RPA, Park S-M, McKibbin CR, Goehler LE: Lipopolysaccharide
suppresses activation of the tuberomammillary histaminergic system
concomitant with behavior: a novel target of immune-sensory pathways.
Neuroscience 2008, 152:273-287. - Bower JE, Ganz PA, Aziz N, Fahey JL: Fatigue and proinflammatory
cytokine activity in breast cancer survivors. Psychosom Med 2002,
64:604-611. - Kubera M, Obuchowicz E, Goehler L, Brzeszcz J, Maes M: In animal models,
psychosocial stress-induced (neuro)inflammation, apoptosis and reduced
neurogenesis are associated to the onset of depression. Prog
Neuropsychopharmacol Biol Psychiatry 2011, 35:744-759. - Leonard BE, Song C: Changes in the immune system in rodent models of
depression. Int J Neuropsychopharmacol 2002, 5:345-356. - Song C, Leonard BE: The olfactory bulbectomised rat as a model of
depression. Neurosci Biobehav Rev 2005, 29:627-647. - Gaykema RPA, Goehler LE: Lipopolysaccharide challenge-induced
suppression of Fos in hypothalamic orexin neurons: their potential role
in sickness behavior. Brain Behav Immun 2009, 23:926-930. - Gaykema RPA, Goehler LE: Ascending caudal medullary catecholamine
pathways drive sickness-induced deficits in exploratory behavior: brain
substrates for fatigue? Brain Behav Immun 2011, 25:443-460. - Anisman H, Merali Z: Anhedonic and anxiogenic effects of cytokine
exposure. Adv Exp Med Biol 1999, 461:199-233. - Lyte M, Li W, Opitz N, Gaykema RP, Goehler LE: Induction of anxiety-like
behavior in mice during the initial stages of infection with the agent of
murine colonic hyperplasia Citrobacter rodentium. Physiol Behav 2006,
89:350-357. - Goehler LE, Lyte M, Gaykema RP: Infection-induced viscerosensory signals
from the gut enhance anxiety: implications for
psychoneuroimmunology. Brain Behav Immun 2007, 21:721-726. - Castex N, Fioramonti J, Fargeas MJ, Bueno L: c-fos expression in specific
rat brain nuclei after intestinal anaphylaxis: involvement of 5-HT3
receptors and vagal afferent fibers. Brain Res 1995, 688:149-160. - Rossi-George A, Urbach D, Colas D, Goldfarb Y, Kusnecov AW: Neuronal,
endocrine, and anorexic responses to the T-cell superantigen
staphylococcal enterotoxin A: dependence on tumor necrosis factoralpha. J Neurosci 2005, 25:5314-5322. - Goehler LE, Gaykema RP, Opitz N, Reddaway R, Badr N, Lyte M: Activation
in vagal afferents and central autonomic pathways: early responses to
intestinal infection with Campylobacter jejuni. Brain Behav Immun 2005,
19:334-344. - Grossberg AJ, Zhu X, Leinninger GM, Levasseur PR, Braun TP, Myers MG Jr,
Marks DL: Inflammation-induced lethargy is mediated by suppression of
orexin neuron activity. J Neurosci 2011, 31:11376-11386. - Maes M, Bosmans E, Suy E, Vandervorst C, De Jonckheere C, Raus J:
Immune disturbances during major depression: upregulated expression
of interleukin-2 receptors. Neuropsychobiology 1990, 24:115-120. - Maes M: Depression is an inflammatory disease, but cell-mediated
immune activation is the key component of depression. Prog
Neuropsychopharmacol Biol Psychiatry 2011, 35:664-675. - Howren MB, Lamkin DM, Suls J: Associations of depression with Creactive protein, IL-1, and IL-6: a meta-analysis. Psychosom Med 2009,
71:171-186. - Maes M, Lin AH, Delmeire L, Van Gastel A, Kenis G, De Jongh R, Bosmans E:
Elevated serum interleukin-6 (IL-6) and IL-6 receptor concentrations in
posttraumatic stress disorder following accidental man-made traumatic
events. Biol Psychiatry 1999, 45:833-839. - Bonaccorso S, Puzella A, Marino V, Pasquini M, Biondi M, Artini M,
Almerighi C, Levrero M, Egyed B, Bosmans E, Meltzer HY, Maes M:
Immunotherapy with interferon-alpha in patients affected by chronic
hepatitis C induces an intercorrelated stimulation of the cytokine
network and an increase in depressive and anxiety symptoms. Psychiatry
Res 2001, 105:45-55. - Wichers MC, Kenis G, Koek GH, Robaeys G, Nicolson NA, Maes M:
Interferon-alpha-induced depressive symptoms are related to changes in
the cytokine network but not to cortisol. J Psychosom Res 2007,
62:207-214. - Anisman H: Cascading effects of stressors and inflammatory immune
system activation: implications for major depressive disorder. J Psychiatry
Neurosci 2009, 34:4-20. - Piser TM: Linking the cytokine and neurocircuitry hypotheses of
depression: a translational framework for discovery and development of
novel anti-depressants. Brain Behav Immun 2010, 24:515-524. - Swiergiel AH, Dunn AJ: Effects of interleukin-1beta and
lipopolysaccharide on behavior of mice in the elevated plus-maze and
open field tests. Pharmacol Biochem Behav 2007, 86:651-659. - Frenois F, Moreau M, O’Connor J, Lawson M, Micon C, Lestage J, Kelley KW,
Dantzer R, Castanon N: Lipopolysaccharide induces delayed FosB/
DeltaFosB immunostaining within the mouse extended amygdala,
hippocampus and hypothalamus, that parallel the expression of
depressive-like behavior. Psychoneuroendocrinol 2007, 32:516-531. - Lacosta S, Merali Z, Anisman H: Influence of acute and repeated
interleukin-2 administration on spatial learning, locomotor activity,
exploratory behaviors, and anxiety. Behav Neurosci 1999, 113:1030-1041. - Song C, Phillips AG, Leonard B: Interleukin 1 beta enhances conditioned
fear memory in rats: possible involvement of glucocorticoids. Eur J
Neurosci 2003, 18:1739-1743. - Nathan C: Points of control in inflammation. Nature 2002, 420:846-852.
- Adib-Conquy M, Cavaillon JM: Compensatory anti-inflammatory response
syndrome. Thromb Haemost 2009, 101:36-47. - Tracey KJ: The inflammatory reflex. Nature 2002, 420:853-859, Review.
- Bone RC: Important new findings in sepsis. JAMA 1997, 278:249.
- Burdette SD, Parilo MA, Kaplan LJ, Bailey H: Systemic inflammatory
response syndrome. Medscape, eMedicine 2010 [http://emedicine.
medscape.com/article/168943], updated April 11, 2012. - Maes M, Meltzer HY, Scharpé S, Bosmans E, Suy E, De Meester I, Calabrese J,
Cosyns P: Relationships between lower plasma L-tryptophan levels and
immune-inflammatory variables in depression. Psychiatry Res 1993,
49:151-165. - Maes M, Scharpé S, Meltzer HY, Okayli G, Bosmans E, D’Hondt P, Vanden
Bossche BV, Cosyns P: Increased neopterin and interferon-gamma
secretion and lower availability of L-tryptophan in major depression:
further evidence for an immune response. Psychiatry Res 1994, 54:143-160. - Maes M, Leonard BE, Myint AM, Kubera M, Verkerk R: The new ‘5-HT’
hypothesis of depression: cell-mediated immune activation induces
indoleamine 2,3-dioxygenase, which leads to lower plasma tryptophan
and an increased synthesis of detrimental tryptophan catabolites
(TRYCATs), both of which contribute to the onset of depression. Prog
Neuropsychopharmacol Biol Psychiatry 2011, 35:702-721. - Song C, Lin A, Bonaccorso S, Heide C, Verkerk R, Kenis G, Bosmans E,
Scharpe S, Whelan A, Cosyns P, de Jongh R, Maes M: The inflammatory
response system and the availability of plasma tryptophan in patients
with primary sleep disorders and major depression. J Affect Disord 1998,
49:211-219. - Werner-Felmayer G, Werner ER, Fuchs D, Hausen A, Reibnegger G,
Wachter H: Tumour necrosis factor-alpha and lipopolysaccharide
enhance interferon-induced tryptophan degradation and pteridine
synthesis in human cells. Biol Chem Hoppe Seyler 1989, 370:1063-1069. - Takikawa O, Yoshida R, Yasui H, Hayaishi O: The relationship between
plasma kynurenine and indoleamine 2,3-dioxygenase activity in the
extrahepatic tissues. In Progress in Tryptophan and Serotonin Research.
Edited by: Schlossberger HG, Kochen W, Linzen B, Steinhart H. Berlin-New
York: Walter de Gruyter and Co; 1984:517-520. - Moroni F, Russi P, Gallo-Mezo MA, Moneti G, Pellicciari R: Modulation of
quinolinic and kynurenic acid content in the rat brain: effects of
endotoxins and nicotinylalanine. J Neurochem 1991, 57:1630-1635. - Bonaccorso S, Marino V, Puzella A, Pasquini M, Biondi M, Artini M,
Almerighi C, Verkerk R, Meltzer H, Maes M: Increased depressive ratings in
patients with hepatitis C receiving interferon-alpha-based
immunotherapy are related to interferon-alpha-induced changes in the
serotonergic system. J Clin Psychopharmacol 2002, 22:86-90. - Maes M, Verkerk R, Bonaccorso S, Ombelet W, Bosmans E, Scharpé S:
Depressive and anxiety symptoms in the early puerperium are related
to increased degradation of tryptophan into kynurenine, a phenomenon
which is related to immune activation. Life Sci 2002, 71:1837-1848. - Toker L, Amar S, Bersudsky Y, Benjamin J, Klein E: The biology of
tryptophan depletion and mood disorders. Isr J Psychiatry Relat Sci 2010,
47:46-55. - O’Connor JC, André C, Wang Y, Lawson MA, Szegedi SS, Lestage J,
Castanon N, Kelley KW, Dantzer R: Interferon-gamma and tumor necrosis
factor-alpha mediate the upregulation of indoleamine 2,3-dioxygenase
and the induction of depressive-like behavior in mice in response to
bacillus Calmette-Guerin. J Neurosci 2009, 29:4200-4209. - Hoes MJ: The clinical significance of an elevated excretion of
xanthurenic acid in psychiatric patients. Acta Psychiatr Belg 1979,
79:638-646. - Møller SE, Kirk L, Honoré P: Tryptophan tolerance and metabolism in
endogenous depression. Psychopharmacology (Berl) 1982, 76:79-83. - Maes M, De Ruyter M, Suy E: Xanthurenic acid flow in 24-hour urine
following L-tryptophan loading in depressive patients. Acta Psychiatr Belg
1986, 86:120-130. - Maes M, De Ruyter M, Suy E: The renal excretion of xanthurenic acid
following L-tryptophan loading in depressed patients. Hum
Psychopharmacol Clin Exp 1987, 2:231-235. - Myint AM, Kim YK, Verkerk R, Scharpé S, Steinbusch H, Leonard B:
Kynurenine pathway in major depression: evidence of impaired
neuroprotection. J Affect Disord 2007, 98:143-151. - Gabbay V, Klein RG, Katz Y, Mendoza S, Guttman LE, Alonso CM, Babb JS,
Hirsch GS, Liebes L: The possible role of the kynurenine pathway in
adolescent depression with melancholic features. J Child Psychol
Psychiatry 2010, 51:935-943. - Steiner J, Walter M, Gos T, Guillemin GJ, Bernstein HG, Sarnyai Z, Mawrin C,
Brisch R, Bielau H, Meyer zu Schwabedissen L, Bogerts B, Myint AM: Severe
depression is associated with increased microglial quinolinic acid in
subregions of the anterior cingulate gyrus: evidence for an immunemodulated glutamatergic neurotransmission? J Neuroinflammation 2011,
8:94. - Sublette ME, Galfalvy HC, Fuchs D, Lapidus M, Grunebaum MF,
Oquendo MA, Mann JJ, Postolache TT: Plasma kynurenine levels are
elevated in suicide attempters with major depressive disorder. Brain
Behav Immun 2011, 25:1272-1278. - Anderson G, Maes M, Berk M: Biological underpinnings of the
commonalities in depression, somatization, and chronic fatigue
syndrome. Med Hypotheses 2012, 78:752-756. - Celik C, Erdem M, Cayci T, Ozdemir B, Ozgur Akgul E, Kurt YG, Yaman H,
Isintas M, Ozgen F, Ozsahin A: The association between serum levels of
neopterin and number of depressive episodes of major depression. Prog
Neuropsychopharmacol Biol Psychiatry 2010, 34:372-375. - Maes M, Ombelet W, De Jongh R, Kenis G, Bosmans E: The inflammatory
response following delivery is amplified in women who previously
suffered from major depression, suggesting that major depression is
accompanied by a sensitization of the inflammatory response system. J
Affect Disord 2001, 63:85-92. - Liukkonen T, Silvennoinen-Kassinen S, Jokelainen J, Räsänen P, Leinonen M,
Meyer-Rochow VB, Timonen M: The association between C-reactive
protein levels and depression: results from the northern Finland 1966
birth cohort study. Biol Psychiatry 2006, 60:825-830. - Hennessy MB, Paik KD, Caraway JD, Schiml PA, Deak T: Proinflammatory
activity and the sensitization of depressive-like behavior during
maternal separation. Behav Neurosci 2011, 125:426-433. - Kawasaki Y, Zhang L, Cheng JK, Ji RR: Cytokine mechanisms of central
sensitization: distinct and overlapping role of interleukin-1beta,
interleukin-6, and tumor necrosis factor-alpha in regulating synaptic and
neuronal activity in the superficial spinal cord. J Neurosci 2008,
28:5189-5194. - Maes M, Ringel K, Kubera M, Berk M, Rybakowski J: Increased autoimmune
activity against 5-HT: a key component of depression that is associated
with inflammation and activation of cell-mediated immunity, and with
severity and staging of depression. J Affect Disord 2012, 136:386-392. - Hochstrasser T, Ullrich C, Sperner-Unterweger B, Humpel C: Inflammatory
stimuli reduce survival of serotonergic neurons and induce neuronal
expression of indoleamine 2,3-dioxygenase in rat dorsal raphe nucleus
organotypic brain slices. Neuroscience 2011, 184:128-138. - Maes M, Bosmans E, De Jongh R, Kenis G, Vandoolaeghe E, Neels H:
Increased serum IL-6 and IL-1 receptor antagonist concentrations in
major depression and treatment resistant depression. Cytokine 1997,
9:853-858. - Maes M, Vandoolaeghe E, Neels H, Demedts P, Wauters A, Meltzer HY,
Altamura C, Desnyder R: Lower serum zinc in major depression is a
sensitive marker of treatment resistance and of the immune/
inflammatory response in that illness. Biol Psychiatry 1997, 42:349-358. - Kubera M, Van Bockstaele D, Maes M: Leukocyte subsets in treatmentresistant major depression. Pol J Pharmacol 1999, 51:547-549.
- O’Brien SM, Scully P, Fitzgerald P, Scott LV, Dinan TG: Plasma cytokine
profiles in depressed patients who fail to respond to selective serotonin
reuptake inhibitor therapy. J Psychiatr Res 2007, 41:326-331. - Jacka FN, Maes M, Pasco JA, Williams LJ, Berk M: Nutrient intakes and the
common mental disorders in women. J Affect Disord . - Maes M, Yirmyia R, Noraberg J, Brene S, Hibbeln J, Perini G, Kubera M,
Bob P, Lerer B, Maj M: The inflammatory & neurodegenerative (I&ND)
hypothesis of depression: leads for future research and new drug
developments in depression. Metab Brain Dis 2009, 24:27-53. - Maes M, Bosmans E, Calabrese J, Smith R, Meltzer HY: Interleukin-2 and
interleukin-6 in schizophrenia and mania: effects of neuroleptics and
mood stabilizers. J Psychiatr Res 1995, 29:141-152. - Maes M, Delange J, Ranjan R, Meltzer HY, Desnyder R, Cooremans W,
Scharpé S: Acute phase proteins in schizophrenia, mania and major
depression: modulation by psychotropic drugs. Psychiatry Res 1997,
66:1-11. - Liu HC, Yang YY, Chou YM, Chen KP, Shen WW, Leu SJ: Immunologic
variables in acute mania of bipolar disorder. J Neuroimmunol 2004,
150:116-122. - Wadee AA, Kuschke RH, Wood LA, Berk M, Ichim L, Maes M: Serological
observations in patients suffering from acute manic episodes. Hum
Psychopharmacol 2002, 17:175-179. - Maes M, Galecki P, Chang YS, Berk M: A review on the oxidative and
nitrosative stress (O&NS) pathways in major depression and their
possible contribution to the (neuro)degenerative processes in that
illness. Prog Neuropsychopharmacol Biol Psychiatry 2011, 35:676-692. - Maes M, Mihaylova I, Leunis JC: Increased serum IgM antibodies directed
against phosphatidyl inositol (Pi) in chronic fatigue syndrome (CFS) and
major depression: evidence that an IgM-mediated immune response
against Pi is one factor underpinning the comorbidity between both
CFS and depression. Neuro Endocrinol Lett 2007, 28:861-867. - Maes M, Mihaylova I, Kubera M, Leunis JC, Geffard M: IgM-mediated
autoimmune responses directed against multiple neoepitopes in
depression: new pathways that underpin the inflammatory and
neuroprogressive pathophysiology. J Affect Disord 2012, 135:414-418. - Wichers MC, Koek GH, Robaeys G, Praamstra AJ, Maes M: Early increase in
vegetative symptoms predicts IFN-alpha-induced cognitive-depressive
changes. Psychol Med 2005, 35:433-441. - Leonard BE, Myint A: Inflammation and depression: is there a causal
connection with dementia? Neurotox Res 2006, 10:149-160. - Song C, Wang H: Cytokines mediated inflammation and decreased
neurogenesis in animal models of depression. Prog
Neuropsychopharmacol Biol Psychiatry 2011, 35:760-768. - Catena-Dell’Osso M, Bellantuono C, Consoli G, Baroni S, Rotella F,
Marazziti D: Inflammatory and neurodegenerative pathways in
depression: a new avenue for antidepressant development? Curr Med
Chem 2011, 18:245-255. - Gorwood P, Corruble E, Falissard B, Goodwin GM: Toxic effects of
depression on brain function: impairment of delayed recall and the
cumulative length of depressive disorder in a large sample of depressed
outpatients. Am J Psychiatry 2008, 165:731-739. - Lampe IK, Hulshoff Pol HE, Janssen J, Schnack HG, Kahn RS, Heeren TJ:
Association of depression duration with reduction of global cerebral
gray matter volume in female patients with recurrent major depressive
disorder. Am J Psychiatry 2003, 160:2052-2054. - McKinnon MC, Yucel K, Nazarov A, MacQueen GM: A meta-analysis
examining clinical predictors of hippocampal volume in patients with
major depressive disorder. J Psychiatry Neurosci 2009, 34:41-54. - Videbech P, Ravnkilde B: Hippocampal volume and depression: a metaanalysis of MRI studies. Am J Psychiatry 2004, 161:1957-1966.
- MacQueen GM, Campbell S, McEwen BS, Macdonald K, Amano S, Joffe RT,
Nahmias C, Young LT: Course of illness, hippocampal function, and
hippocampal volume in major depression. Proc Natl Acad Sci USA 2003,
100:1387-1392. - Lacerda AL, Nicoletti MA, Brambilla P, Sassi RB, Mallinger AG, Frank E,
Kupfer DJ, Keshavan MS, Soares JC: Anatomical MRI study of basal ganglia
in major depressive disorder. Psychiatry Res 2003, 124:129-140. - Stockmeier CA, Mahajan GJ, Konick LC, Overholser JC, Jurjus GJ, Meltzer HY,
Uylings HB, Friedman L, Rajkowska G: Cellular changes in the postmortem
hippocampus in major depression. Biol Psychiatry 2004, 56:640-650. - Drevets WC, Price JL, Furey ML: Brain structural and functional
abnormalities in mood disorders: implications for neurocircuitry models
of depression. Brain Struct Funct 2008, 213:93-118. - Harrison NA, Brydon L, Walker C, Gray MA, Steptoe A, Critchley HD:
Inflammation causes mood changes through alterations in subgenual
cingulate activity and mesolimbic connectivity. Biol Psychiatry 2009,
66:407-414. - Koenigs M, Grafman J: The functional neuroanatomy of depression:
distinct roles for ventromedial and dorsolateral prefrontal cortex. Behav
Brain Res 2009, 201:239-243. - Park S-M, Gaykema RPA, Goehler LE: How does immune challenge inhibit
ingestion of palatable food? Systemic lipopolysaccharide modulates key
nodal points of feeding neurocircuitry. Brain Behav Immun 2008,
22:1160-1172. - Kauer-Sant’Anna M, Kapczinski F, Andreazza AC, Bond DJ, Lam RW,
Young LT, Yatham LN: Brain-derived neurotrophic factor and
inflammatory markers in patients with early- vs. late-stage bipolar
disorder. Int J Neuropsychopharmacol 2009, 12:447-458. - Jancsár SM, Leonard BE: The effects of antidepressant drugs on
conditioned taste aversion learning of the olfactory bulbectomized rat.
Neuropharmacology 1981, 20:1341-1345. - Kumar RK, Wakefield D: Inflammation: chronic. eLS 2010, DOI: 10.1002/
- a0000944. {ED Query: I couldn’t find this ref. in PubMed so
left it as is.}. - Straub RH: Evolutionary medicine and chronic inflammatory state-known
and new concepts in pathophysiology. J Mol Med (Berl) 2012, 90:523-534. - Jewkes RK, Dunkle K, Nduna M, Jama PN, Puren A: Associations between
childhood adversity and depression, substance abuse and HIV and HSV2
incident infections in rural South African youth. Child Abuse Negl 2010,
34:833-841. - Pearce BD, Kruszon-Moran D, Jones JL: The relationship between
Toxoplasma gondii infection and mood disorders in the Third National
Health and Nutrition Survey. Biol Psychiatry . - Maes M: An intriguing and hitherto unexplained co-occurrence:
depression and chronic fatigue syndrome are manifestations of shared
inflammatory, oxidative and nitrosative (IO&NS) pathways. Prog
Neuropsychopharmacol Biol Psychiatry 2011, 35:784-794. - Owe-Larsson B, Säll L, Salamon E, Allgulander C: HIV infection and
psychiatric illness. Afr J Psychiatry 2009, 12:115-128. - Maes M, Kubera M, Leunis JC, Berk M: Increased IgA and IgM responses
against gut commensals in chronic depression: further evidence for
increased bacterial translocation or leaky gut. J Affect Disord . - Hassett AL, Radvanski DC, Buyske S, Savage SV, Sigal LH: Psychiatric
comorbidity and other psychological factors in patients with “chronic
Lyme disease”. Am J Med 2009, 122:843-850. - Strijdom SC, Berk M: Lyme disease in South Africa. S Afr Med J 1996,
86(Suppl):741-744. - van den Pol AN: Viral infection leading to brain dysfunction: more
prevalent than appreciated? Neuron 2009, 64:17-20. - Maes M, Song C, Lin A, DeJong R, Van Gastel A, Kenis G, Bosmans E,
DeMeester I, Neels H, Janca A, Scharpe S, Smith RS: Immune and clinical
correlates of psychological stress-induced production of interferon-γ and
IL-10 in humans. In Cytokines, Stress and Immunity. Edited by: Plotnikoff NP,
Faith RE, Murgo AJ, Good RA. New York: Taylor and Francis; 1998:39-50. - Wohleb ES, Hanke ML, Corona AW, Powell ND, Stiner LM, Bailey MT,
Nelson RJ, Godbout JP, Sheridan JF: β-Adrenergic receptor antagonism
prevents anxiety-like behavior and microglial reactivity induced by
repeated social defeat. J Neurosci 2011, 31:6277-6288. - Williams LJ, Pasco JA, Jacka FN, Henry MJ, Dodd S, Berk M: Depression and
bone metabolism. A review. Psychother Psychosom 2009, 78:16-25. - Pavlovićc Z, Delićc D, Marićc NP, Vukovićc O, Jašovićc-Gašićc M: Depressive
symptoms in patients with hepatitis C treated with pegylated interferon
alpha therapy: a 24-week prospective study. Psychiatr Danub 2011,
23:370-377. - Wichers MC, Koek GH, Robaeys G, Verkerk R, Scharpé S, Maes M: IDO and
interferon-alpha-induced depressive symptoms: a shift in hypothesis
from tryptophan depletion to neurotoxicity. Mol Psychiatry 2005,
10:538-544. - Kendler KS, Thornton LM, Gardner CO: Genetic risk, number of previous
depressive episodes, and stressful life events in predicting onset of
major depression. Am J Psychiatry 2001, 158:582-586. - Laugeray A, Launay JM, Callebert J, Surget A, Belzung C, Barone PR:
Evidence for a key role of the peripheral kynurenine pathway in the
modulation of anxiety- and depression-like behaviours in mice: Focus
on individual differences. Pharmacol Biochem Behav 2011, 98:161-168. - Wrynn AS, Mac Sweeney CP, Franconi F, Lemaire L, Pouliquen D,
Herlidou S, Leonard BE, Gandon J, de Certaines JD: An in-vivo magnetic
resonance imaging study of the olfactory bulbectomized rat model of
depression. Brain Res 2000, 879:193-199. - Wang D, Noda Y, Tsunekawa H, Zhou Y, Miyazaki M, Senzaki K,
Nabeshima T: Behavioural and neurochemical features of olfactory
bulbectomized rats resembling depression with comorbid anxiety. Behav
Brain Res 2007, 178:262-273. - Huang Y, Henry CJ, Dantzer R, Johnson RW, Godbout JP: Exaggerated
sickness behavior and brain proinflammatory cytokine expression in
aged mice in response to intracerebroventricular lipopolysaccharide.
Neurobiol Aging 2008, 29:1744-1753. - Nakanishi H, Hayashi Y, Wu Z: The role of microglial mtDNA damage in
age-dependent prolonged LPS-induced sickness behavior. Neuron Glia
Biol 2011, 28:1-7. - Taepavarapruk P, Song C: Reductions of acetylcholine release and nerve
growth factor expression are correlated with memory impairment
induced by interleukin-1beta administrations: effects of omega-3 fatty
acid EPA treatment. J Neurochem 2010, 112:1054-1064. - Lai AY, Swayze RD, El-Husseini A, Song C: Interleukin-1 beta modulates
AMPA receptor expression and phosphorylation in hippocampal
neurons. J Neuroimmunol 2006, 175:97-106 - Kinney DK, Tanaka M: An evolutionary hypothesis of depression and its
symptoms, adaptive value, and risk factors. J Nerv Ment Dis 1980,
97:561-567. - Raison CL, Miller AH: The evolutionary significance of depression in
Pathogen Host Defense (PATHOS-D). Mol Psychiatr 2012, doi: 10.1038/
mp.2012.2. PubMed PMID: 22290120. - Olde Hartman TC, Borghuis MS, Lucassen PL, van de Laar FA, Speckens AE,
van Weel C: Medically unexplained symptoms, somatisation disorder and
hypochondriasis: course and prognosis. A systematic review. J Psychosom
Res 2009, 66:363-377. - Xia Z, DePierre JW, Nassberger L: Tricyclic antidepressants inhibit IL-6, IL-
1b and TNF-a release in human blood monocytes and IL-2 and
interferon-g in T cells. Immunopharmacology 1996, 34:27-37. - Maes M, Song C, Lin AH, Bonaccorso S, Kenis G, De Jongh R, Bosmans E,
Scharpe S: Negative immunoregulatory effects of antidepressants:
inhibition of interferon-gamma and stimulation of interleukin-10
secretion. Neuropsychopharmacol 1999, 20:370-379. - Brustolim D, Ribeiro-dos-Santos R, Kast RE, Altschuler EL, Soares MB: A new
chapter opens in anti-inflammatory treatments: the antidepressant
bupropion lowers production of tumor necrosis factor-alpha and
interferon-gamma in mice. Int Immunopharmacol 2006, 6:903-907. - Castanon N, Bluthé RM, Dantzer R: Chronic treatment with the atypical
antidepressant tianeptine attenuates sickness behavior induced by
peripheral but not central lipopolysaccharide and interleukin-1beta in
the rat. Psychopharmacology (Berl) 2001, 154:50-60. - Jiang Y, Deacon R, Anthony DC, Campbell SJ: Inhibition of peripheral TNF
can block the malaise associated with CNS inflammatory diseases.
Neurobiol Dis 2008, 632:125-132. - Maes M, Meltzer HY, Bosmans E, Bergmans R, Vandoolaeghe E, Ranjan R,
Desnyder R: Increased plasma concentrations of interleukin-6, soluble
interleukin-6, soluble interleukin-2 and transferrin receptor in major
depression. J Affect Disord 1995, 34:301-309. - Maes M, Fišar Z, Medina M, Scapagnini G, Nowak G, Berk M: New drug
targets in depression: inflammatory, cell-mediated immune, oxidative
and nitrosative stress, mitochondrial, antioxidant, and neuroprogressive
pathways. And new drug candidates-Nrf2 activators and GSK-3
inhibitors. Inflammopharmacology 2012, 20:127-150. - Hannestad J, DellaGioia N, Bloch M: The effect of antidepressant
medication treatment on serum levels of inflammatory cytokines: a
meta-analysis. Neuropsychopharmacology 2011, 36:2452-2459. - Kirsch I: Antidepressants and the placebo response. Epidemiol Psichiatr Soc
2009, 18:318-322. - Tuma T: Outcome of hospital treated depression at 4.5 years. An elderly
and a younger cohort compared. Br J Psychiatry 2000, 176:224-228. - Twenge JM, Gentile B, DeWall CN, Ma D, Lacefield K, Schurtz DR: Birth
cohort increases in psychopathology among young Americans, 1938-
2007: A cross-temporal meta-analysis of the MMPI. Clin Psychol Rev 2010,
30:145-154.
Pre-publication history
The pre-publication history for this paper can be accessed here:
http://www.biomedcentral.com/1741-7015/10/66/prepub
doi:10.1186/1741-7015-10-66
Cite this article as: Maes et al.: Depression and sickness behavior are
Janus-faced responses to shared inflammatory pathways. BMC Medicine
2012 10:66.

病気行動とは、感染の過程で病気の人に生じる一連の適応行動の変化のことです。[ 1 ] これらは通常、必ずではありませんが[ 2 ]発熱を伴い、生存を助けます。このような病気の反応には、無気力、抑うつ、不安、倦怠感、食欲不振、[ 3 ] [ 4 ]眠気、[ 5 ]痛覚過敏、[ 6 ]毛繕いの減少[ 1 ] [ 7 ]集中力の低下などがあります。[ 8 ] 病気行動は、感染性病原体に対処するために生物の優先順位を再編成する動機づけ状態です。[ 8 ] [ 9 ]うつ病、[ 10 ]および癌で起こる苦しみのいくつかの側面 を理解するのに関連があると示唆されています。
歴史
[編集]
病気の動物は長い間、農家の間で異なる行動をとると認識されてきた。当初は、感染と戦うために必要な体のプロセスにエネルギーを向けることによって生じる肉体的衰弱によるものと考えられていた。しかし、1960年代に、動物が血液を介して第X因子を産生し、それが脳に作用して病気の行動を引き起こすことが示された。[ 11 ] [ 12 ] 1987年、ベンジャミン・L・ハートは、それらが生存への適応であり、妨げられれば動物の感染と戦う能力に不利になると主張する様々な研究結果をまとめた。1980年代には、血液媒介因子が、リポ多糖類(グラム陰性細菌の細胞壁成分)に反応して免疫系で活性化白血球によって産生される炎症性サイトカインであることが示された。これらのサイトカインは、様々な体液経路と神経経路によって視床下部と脳の他の領域に作用する。さらなる研究により、脳は免疫活性化とは独立して、病気の行動のさまざまな要素を制御することも学習できることが示されました。[引用が必要]
2015年、シャカールとシャカール[ 13 ]は、病気行動は主に感染動物の血縁者を伝染病から守るために発達したと提唱しました。この理論は、英国のエヤム教区にちなんでエヤム仮説と呼ばれ、病気行動は感染者同士の直接的な接触を制限し、環境汚染を防ぎ、健康状態を広く知らせることで、感染者の社会集団を保護します。血縁淘汰は、進化を通じてこのような行動を促進すると考えられます。しかし、人間のように高度に向社会的な種では、病気行動は他者が病気の個体を助け、世話をする動機となるシグナルとして機能する可能性があります。[ 14 ]
利点
[編集]
一般的な利点
[編集]
病気の行動は様々な側面から動物の運動を制限します。活動で消費されなかった代謝エネルギーは、体温上昇を伴う発熱反応に転用されます。[ 1 ]また、認知能力や身体能力が低下している間、動物は捕食動物への曝露も制限されます。[ 1 ]
具体的な利点
[編集]
病気行動の個々の要素には、それぞれ特有の利点があります。食欲不振は食物摂取を制限し、その結果、腸管における鉄の利用可能性(および腸管吸収)を低下させます。鉄は細菌の繁殖を助ける可能性があるため、病気の際には鉄の減少が有益です。 [ 15 ]発熱時には、この抗菌作用のために血漿中の鉄濃度が低下します。[ 16 ] 痛覚閾値の低下により、動物は損傷や炎症を起こした組織に圧力をかけ、治癒を妨げることのないように注意を払います。[ 1 ]毛繕いの減少は、水分損失を減らすため、適応的です。[ 1 ]
包括的なフィットネスの利点
[編集]
「エヤム仮説」[ 13 ]によれば、病気行動は、移動の抑制と社会的無関心を促すことで、個体と近親者との直接的な接触を制限する。飲食の減少により下痢や排便が抑制され、環境汚染が減少する。また、身繕いの減少、姿勢、歩き方、発声の変化により、近親者に健康状態の悪化を知らせる。全体として、病気行動はさらなる感染率を低下させるが、この特性は近親淘汰によって伝播される可能性が高い。[要出典]
社会的優位性
[編集]
人類は狩猟採集時代からその後も、病気や怪我の際に互いに助け合ってきた。他者に救済、援助、そしてケアを切実に必要としていることを納得させることで、病人の生存率を高めた。発熱に伴うエネルギー消費や高体温による潜在的な危害といった高い直接的コスト、そして活動不足、社会への無関心、食欲不振といった高い機会コストにより、病気という行動は非常にコストがかかり、それゆえに必要性を示す確かなシグナルとなる。[ 14 ]
免疫制御
[編集]
リポ多糖類は免疫系を刺激して炎症性サイトカイン IL-1、IL-6、腫瘍壊死因子(TNF)を産生する。 [ 17 ]末梢に放出されたこれらのサイトカインは、迷走神経を介した一次入力を伴う高速伝達経路[ 18 ] [ 19 ]と、脈絡叢および脳室周囲器官から発生し、容積伝達によって脳実質に拡散する低速伝達経路を介して脳に作用する。[ 20 ]末梢サイトカインは脳に直接進入することができるが[ 21 ] [ 22 ]、一般に血液脳関門を容易に受動的に拡散しない大きな親油性のポリペプチドタンパク質である。それらはまた、病気の行動を引き起こす脳内の他のサイトカインの発現を誘導する可能性がある。[ 23 ] [ 24 [ 25 ]
行動条件付け
[編集]
病気行動の構成要素は条件付き連合によって学習されます。例えば、サッカリン溶液が病気行動の特定の側面を引き起こす化学物質と一緒に与えられた場合、その後、サッカリン溶液自体がその行動を引き起こすようになります。[ 26 ] [ 27 ]
病状
[編集]
うつ
[編集]
大うつ病性障害は病気行動とほぼ同じであるという説があり、循環サイトカインの異常による病気行動の不適応症状である可能性が示唆されている。[ 28 ] [ 29 ] [ 30 ]さらに、抗うつ薬による慢性治療はげっ歯類において病気行動の症状を軽減するが、急性治療には効果がないことがわかっている。[ 31 ]免疫反応後のインターロイキン-6による気分への影響は、うつ病の病因に関与する領域である前帯状皮質膝下帯状皮質内の活動増加と関連付けられている。[ 32 ] [ 33 ]炎症に 伴う気分変化は、脳のこの部分と扁桃体、内側前頭前皮質、側坐核、および上側頭溝との機能的連結性を低下させる可能性もある。[ 32 ]
がんの副作用
[編集]
癌では、病気と化学療法の両方が炎症性サイトカインの放出を引き起こし、それが副作用として病気行動を引き起こす可能性がある。[ 34 ] [ 35 ]
参照
[編集]
参考文献
[編集]
- ^ジャンプ先:a b c d e f Hart, BL (1988). 「病気の動物の行動の生物学的基礎」.Neuroscienceand Biobehavioral Reviews.12(2):123–137.doi:10.1016/S0149-7634(88)80004-6.PMID 3050629.S2CID 17797005.
- ^ Kent, S.; Bluthe, RM; Dantzer, R.; Hardwick, AJ; Kelley, KW; Rothwell, NJ; Vannice, JL (1992). 「インターロイキン1の発熱作用と行動作用は異なる受容体メカニズムによって媒介される」. Proceedings of the National Academy of Sciences of the United States of America . 89 (19): 9117– 9120. Bibcode : 1992PNAS…89.9117K . doi : 10.1073/pnas.89.19.9117 . PMC 50076. PMID 1409612 .
- ^ Exton, MS (1997). 「感染誘発性食欲不振:能動的な宿主防御戦略」. Appetite . 29 (3): 369– 383. doi : 10.1006/appe.1997.0116 . PMID 9468766 . S2CID 10465902 .
- ^ Murray, MJ; Murray, AB (1979). 「宿主防御機構としての感染性食欲不振症」.アメリカ臨床栄養学誌. 32 (3): 593– 596. doi : 10.1093/ajcn/32.3.593 . PMID 283688 .
- ^ Mullington, J.; Korth, C.; Hermann, DM; Orth, A.; Galanos, C.; Holsboer, F.; Pollmächer, T. (2000). 「エンドトキシンのヒト睡眠に対する用量依存的影響」. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology . 278 (4): R947 – R955 . doi : 10.1152 /ajpregu.2000.278.4.r947 . PMID 10749783. S2CID 10272455 .
- ^ Maier, SF; Wiertelak, EP; Martin, D; Watkins, LR (1993). 「インターロイキン-1は塩化リチウムおよびエンドトキシンによって生じる行動性痛覚過敏を媒介する」. Brain Research . 623 (2): 321– 324. doi : 10.1016/0006-8993(93)91446-Y . PMID 8221116. S2CID 40529634 .
- ^ Dantzer R, Kelley KW (2007年2月). 「サイトカイン誘発性疾患行動に関する20年間の研究」 . Brain Behav. Immun. 21 (2): 153– 160. doi : 10.1016/j.bbi.2006.09.006 . PMC 1850954. PMID 17088043 .
- ^ジャンプ先:a b Kelley, KW; Bluthé, RM; Dantzer, R; Zhou, JH; Shen, WH; Johnson, RW; Broussard, SR (2003). 「サイトカイン誘発性疾患行動」.脳・行動・免疫.171):S112 –S118.doi:10.1016/S0889-1591(02)00077-6.PMID12615196.S2CID25400611.
- ^ Johnson, RW (2002). 「病気行動の概念:4つの重要な発見の簡潔な時系列的説明」. Veterinary Immunology and Immunopathology . 87 ( 3–4 ): 443– 450. doi : 10.1016/S0165-2427(02)00069-7 . PMID 12072271 .
- ^ Dantzer, Robert (2009年5月). 「サイトカイン、病気行動、そしてうつ病」 . Immunology and Allergy Clinics of North America . 29 (2): 247– 264. doi : 10.1016/j.iac.2009.02.002 . PMC 2740752. PMID 19389580. 2015年2月23日閲覧.
- ^ Holmes, JE; Miller, NE (1963). 「アルビノラットにおける細菌性エンドトキシンによる水分摂取量、食物摂取量、および体温への影響」 . The Journal of Experimental Medicine . 118 ( 4): 649– 658. doi : 10.1084/jem.118.4.649 . PMC 2137667. PMID 14067912 .
- ^ ミラー、N. (1964)「動機づけと病気の行動的影響に関するいくつかの心理生理学的研究」Bull. Br. Psychol. Soc. 17: 1–20
- ^ジャンプ先:a b Shakhar K, Shakhar G (2015年10月).「感染するとなぜ気分が悪くなるのか ― 利他主義が影響するのか?」.PLOS Biol.13(10): e1002276.doi:/ journal.pbio.1002276 .PMC 4608734. PMID26474156.
- ^ジャンプ先:a b Steinkopf L (2015年8月).「症状のシグナル理論:プラセボ効果の進化論的説明」.進化心理学.13(3): 100.doi: 10.1177/1474704915600559 .PMC 10480909. PMID37924177.
- ^ Kluger, MJ; Rothenburg, BA (1979). 「発熱と鉄減少:細菌感染に対する宿主防御反応としての相互作用」. Science . 203 (4378): 374– 376. Bibcode : 1979Sci…203..374K . doi : 10.1126/science.760197 . PMID 760197 .
- ^ Weinberg, ED (1984). 「鉄の保持:感染と腫瘍形成に対する防御」.生理学レビュー. 64 (1): 65– 102. doi : 10.1152/physrev.1984.64.1.65 . PMID 6420813 .
- ^ Konsman, JP; Parnet, P; Dantzer, R (2002年3月). 「サイトカイン誘発性疾患行動:メカニズムと影響」. Trends in Neurosciences . 25 (3): 154– 159. doi : 10.1016/s0166-2236(00)02088-9 . PMID 11852148. S2CID 29779184 .
- ^ Goehler, LE; Gaykema, RP; Nguyen, KT; Lee, JE; Tilders, FJ; Maier, SF; Watkins, LR (1999). 「腹部迷走神経の免疫細胞におけるインターロイキン-1β:免疫系と神経系のつながり?」 . The Journal of Neuroscience . 19 (7): 2799– 2806. doi : 10.1523 / JNEUROSCI.19-07-02799.1999 . PMC 6786076. PMID 10087091 .
- ^ Goehler, LE; Relton, JK; Dripps, D.; Kiechle, R.; Tartaglia, N.; Maier, SF; Watkins, LR (1997). 「迷走神経傍神経節はビオチン化インターロイキン-1受容体拮抗薬に結合する:免疫と脳間のコミュニケーションにおける可能性のあるメカニズム」Brain Research Bulletin . 43 (3): 357– 364. doi : 10.1016/s0361-9230(97)00020-8 . PMID 9227848 . S2CID 22591654 .
- ^ Konsman, JP; Kelley, K.; Dantzer, R. (1999). 「ラット脳におけるリポ多糖誘導性Fos、インターロイキン-1β、および誘導性一酸化窒素合成酵素の発現の時空間的関係」Neuroscience . 89 (2): 535– 548. doi : 10.1016/s0306-4522(98)00368-6 . PMID 10077334 . S2CID 25173830 .
- ^ Banks, WA; Kastin, AJ; Gutierrez, EG (1994). 「マウス血液脳関門を介したインターロイキン-6の透過」Neuroscience Letters . 179 ( 1– 2): 53– 56. doi : 10.1016/0304-3940(94)90933-4 . PMID 7845624 . S2CID 22712577 .
- ^ Banks, WA; Ortiz, L.; Plotkin, SR; Kastin, AJ (1991). 「ヒトインターロイキン(IL)1α、マウスIL-1α、マウスIL-1βは、共通の飽和メカニズムによってマウスの血液から脳へ輸送される」. The Journal of Pharmacology and Experimental Therapeutics . 259 (3): 988– 996. PMID 1762091 .
- ^ Ban, E.; Haour, F.; Lenstra, R. (1992). 「末梢リポ多糖投与による脳内インターロイキン1遺伝子発現の誘導」.サイトカイン. 4 (1): 48– 54. doi : 10.1016/1043-4666(92)90036-Q . PMID 1535519 .
- ^ Van Dam, AM; Brouns, M.; Louisse, S.; Berkenbosch, F. (1992). 「エンドトキシン投与ラットの脳におけるマクロファージおよび分岐ミクログリアにおけるインターロイキン-1の出現:非特異的な病気の症状誘発経路か?」Brain Research . 588 (2): 291– 296. doi : 10.1016/0006-8993(92) 91588-6 . PMID 1393581. S2CID 35583973 .
- ^ Brydon, L.; Walker, C.; Wawrzyniak, A.; Whitehead, D.; Okamura, H.; Yajima, J.; Tsuda, A.; Steptoe, A. (2009). 「ヒトにおける炎症性サイトカインおよび疾病反応に対する心理的ストレスと免疫ストレスの相乗効果」 . Brain, Behavior, and Immunity . 23 ( 2): 217– 224. doi : 10.1016/j.bbi.2008.09.007 . PMC 2637301. PMID 18835437 .
- ^ Exton, MS; Bull, DF; King, MG (1995). 「リポ多糖類誘発性食欲不振の行動条件付け」.生理学と行動. 57 (2): 401– 405. doi : 10.1016/0031-9384(94)00249-5 . PMID 7716224. S2CID 41061406 .
- ^ Exton, MS; Bull, DF; King, MG; Husband, AJ (1995). 「行動条件付けによる体温と睡眠状態の修正」.生理学と行動. 57 (4): 723– 729. doi : 10.1016/0031-9384(94)00314-9 . PMID 7777610. S2CID 927502 .
- ^ イルミヤ、R.;ヴァイデンフェルド、J.ポラック、Y.モラグ、M.モラグ、A.アヴィツル、R.バラク、O.ライヒェンベルク、A.コーエン、E.シャビット、Y.オバディア、H. (1999)。 「サイトカイン、「一般的な病状によるうつ病」、および抗うつ薬」。サイトカイン、ストレス、うつ病。実験医学と生物学の進歩。 Vol. 461. pp. 283–316 .土井: 10.1007/978-0-585-37970-8_16。ISBN 978-0-306-46135-4. PMID 10442179 .
- ^ Dantzer, R.; O’Connor, JC; Freund, GG; Johnson, RW; Kelley, KW (2008). 「炎症から病気とうつ病へ:免疫系が脳を支配するとき」 . Nature Reviews Neuroscience . 9 (1): 46– 56. doi : 10.1038 /nrn2297 . PMC 2919277. PMID 18073775 .
- ^ Maes, M. (2008). 「うつ病におけるサイトカイン仮説:炎症、酸化ストレスおよびニトロソ化ストレス(IO&NS)、そしてリーキーガットはうつ病の補助療法の新たな標的となる」Neuro Endocrinology Letters . 29 (3): 287– 291. PMID 18580840 .
- ^ Yirmiya, R. (1996). 「エンドトキシンはラットにうつ病様エピソードを引き起こす」. Brain Research . 711 ( 1– 2): 163– 174. doi : 10.1016/0006-8993(95)01415-2 . PMID 8680860. S2CID 46133689 .
- ^ジャンプ先:a b Harrison NA, Brydon L, Walker C, Gray MA, Steptoe A, Critchley HD (2009年9月).「炎症は膝下帯状皮質活動と中脳辺縁系連結性の変化を介して気分変動を引き起こす」.Biol Psychiatry.66(5):407–414.doi:10.1016/j.biopsych.2009.03.015.PMC 2885494. PMID19423079.
- ^ Drevets WC, Savitz J, Trimble M (2008年8月). 「気分障害における前帯状皮質膝下層」 . CNS Spectr . 13 (8): 663– 681. doi : 10.1017/ s1092852900013754 . PMC 2729429. PMID 18704022 . PDF: http://mbldownloads.com/0808CNS_BrainRegions.pdf
- ^ Cleeland, CS; Bennett, GJ; Dantzer, R.; Dougherty, PM; Dunn, AJ; Meyers, CA; Miller, AH; Payne, R.; Reuben, JM; Wang, XS; Lee, BN (2003). 「がんの症状とがん治療は共通の生物学的メカニズムによるものか?」Cancer . 97 (11): 2919– 2925. doi : 10.1002/cncr.11382 . PMID 12767108 . S2CID 23198802 .
- ^ Myers, JS (2008). 「炎症性サイトカインと病気行動:うつ病およびがん関連症状への影響」. Oncology Nursing Forum . 35 (5): 802– 807. doi : 10.1188/08.ONF.802-807 . PMID 18765326 .

