6 海馬
シナプス、回路、ネットワーク
前の章では、海馬が脳機能において果たす重要な役割を強調しました。これは脳の最も高度に接続されたハブの 1 つであり、デフォルト システムを含むいくつかの主要な固有接続ネットワーク (ICN) に参加しています。さらに、これは従来の「大脳辺縁系」の一部であり、感情の処理に大きく寄与する主に皮質下の脳ネットワークです。大脳辺縁系の概念は、脳ネットワークの複雑な相互作用に関する情報の増加に応じて長年にわたって進化しており、海馬は現在、認知、感情、動機付けシステムのインターフェースで機能する重要な構造とみなされています。 Joseph LeDoux は、脳の高度に接続された領域を「収束ゾーン」、つまりマルチモーダルな入力が処理され、概念が生成される領域であると説明しました。彼の用語では、海馬は「超収束ゾーン」としてさらに高い位置を占めており、非常に高い接続性の部位としての役割を反映しています。海馬が複数の主要な精神疾患に関与していることがますます明らかになりつつある。海馬の構造や機能の異常は、アルツハイマー病やその他の認知症、健忘症、大うつ病、双極性障害、統合失調症、心的外傷後ストレス障害などと関連している。海馬はシナプス機能とシナプス可塑性の研究に好まれている部位であるため、その接続性と内部動作は他の多くの脳領域よりもよく理解されています。したがって、細胞およびシナプスの処理が神経系の機能および臨床症状の発生にどのように関連しているかを総合して、その機能をある程度詳細に説明します。これらの細胞およびシナプスのメカニズムは海馬で最も詳細に研究されていますが、他の脳領域および脳ネットワークの機能にも関連しています。したがって、この章で概説する原則は、脳システムの生理学を理解する上で一般的に重要です。以下の議論には、第 3 章で概説されている情報を含む、神経生理学に関するいくつかの基本的な知識が必要です。また、読者には、エリック・カンデルの神経科学の教科書、またはカプランとサドックの精神医学の包括的な教科書の現行版に掲載されているゾラムスキーらによる書評を背景情報として参照することをお勧めします。
なぜ海馬が重要なのでしょうか?
海馬は新しい記憶の形成において極めて重要です。記憶は私たちの生活の重要な要素であり、新しさを認識し、将来を想像し、意思決定を行う能力を含む精神機能のあらゆる側面に影響を与えます。第 1 章で述べたように、記憶にはいくつかの種類があり、異なる領域で処理されますが、手続き記憶 (自転車の乗り方など) は脳の運動経路を利用します。たとえば、感情的な記憶は主に、背側線条体、運動皮質、小脳などの扁桃体に暗号化されています。海馬は、(「意味論的記憶」)を含む学習の一種である「宣言的記憶」の生成に関与しています。陳述記憶は、「人生経験(「エピソード記憶」)や世界に関する事実(「暗黙記憶」)を思い出す明示的な能力」と呼ばれることもあります。暗黙記憶には海馬は必要ありません。
宣言的記憶には複数の脳領域が関与しますが、海馬は宣言的記憶の形成と新皮質の長期記憶への初期記憶痕跡の転送において重要かつ時間制限のある役割を果たします。海馬が両側に損傷すると、記憶への影響は壊滅的になります。個人は新しい宣言的記憶を形成する能力を失います。彼らは適切な方法で行動し、社会的に交流することができますが、新しい経験の記憶はありません。特定の薬物(アルコールやベンゾジアゼピンなど)の影響下では、同様ではありますが持続性はそれほど高くない健忘状態が観察されます。ここでは、個人には明確な期間(「ブラックアウト」と呼ばれる)があり、その間は注意力があり対話的ですが、新しい記憶を形成することができません。これらの停電は一時的なもので、分散された海馬の記憶ネットワークに対する薬物の影響によって引き起こされます。
海馬がどのように機能するかを調べることで、情報を処理し統合するために脳が使用するメカニズムの多くを理解し始めることができます。精神疾患の治療はこれらのプロセスのさまざまな要素に直接影響を与えるため、このようなプロセスを概念的に理解することが重要です。この章では、解剖学的構造と神経構造、情報の電気的処理、化学シグナル伝達、および遺伝子発現に関わる概念を統合します。次の章では、精神医学に関連する伝達物質と受容体の基本原理を検討します。
海馬とは何ですか?
海馬は、側頭葉の内側の両側に位置する脳領域です。これは解剖学者によって「古皮質」と説明されており、前頭前皮質 (PFC) などの新皮質に通常見られる 6 層ではなく、3 つの異なる層を持つ皮質の系統発生的に古い部分を意味します。 「海馬」という名前は、解剖された構造がタツノオトシゴ(ラテン語で海馬)に似ているため、初期の組織学者によって造られました。他の解剖学者は、それが雄羊の角に似ていると考え、人間の体と雄羊の角を持つエジプトの神アンモンにちなんで、この構造を「コルヌ・アンモニス」(アンモンの角)と呼びました。アンモニス角 (CA) という名称は、海馬の小領域 (CA1、CA2、CA3、および CA4 領域) を表すために今日でも使用されています。CA4 領域は歯状回から CA3 への移行ゾーンであり、個別に考慮されることはほとんどありません)。
————————図 6-1
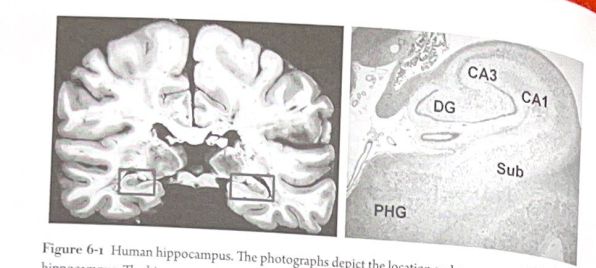
図 6-1 人間の海馬。写真は人間の海馬の位置と構造を示しています。海馬は、側頭葉内側の深部にある折り畳まれた領域です (左のパネル)。右のパネルはヒト海馬の顕微鏡解剖学的構造を示し、歯状回 (DG)、CA3 および CA1 領域、海馬台 (Sub)、および海馬傍回 (PHG) の位置を強調しています。 (図はセントルイスのワシントン大学ナイジェル・ケアンズ氏のご厚意によるものです。)
————————
海馬内には、いくつかの主要な構造的細分があります (図 6-1)。これらの 1 つは歯状回で、横向きの V 字型の構造で、嗅内皮質と呼ばれる近くの脳領域からの興奮性ニューロン入力の海馬入口として機能します。これらの神経入力は神経伝達物質グルタミン酸を放出します。古典的な高速興奮性伝達物質であるグルタミン酸は、歯状顆粒細胞、歯状の主要な(興奮性)ニューロンを、これらの細胞の膜を脱分極させることによって刺激します。実際、グルタミン酸は、イオンチャネル受容体と代謝指向性受容体(G タンパク質共役)の両方を含む、いくつかの異なるグルタミン酸特異的受容体を利用することにより、さまざまな方法で顆粒細胞を興奮させます。これらのさまざまな種類の受容体は、情報がどのように処理されるかを理解するために重要になります。これについては、この章で後ほど説明します。入ってくる接続 (「求心性神経」と呼ばれる) は、穿孔路と呼ばれる神経線維を介して歯状回に入り、顆粒細胞の樹状突起にシナプスします。次に、顆粒細胞は、苔状線維を介して、CA3 野の錐体(興奮性)ニューロンに興奮性(グルタミン酸)入力を送ります。この経路は、CA3 ニューロンの発火を駆動するために大きくて非常に強力なシナプスを使用します。次に、CA3 野は、シェーファー側副路と呼ばれる軸索系を介して、その興奮性軸索を CA1 野の錐体ニューロンに送ります。
穿孔経路、苔状線維、およびシェーファー側副路は、これらが 3 つのシナプス単位として機能することが多いことを示すために、総称して「三シナプス経路」と呼ばれます。このシステムは、情報処理のための主要な神経伝達物質としてグルタミン酸を使用する、効果的なフィードフォワード海馬中心の興奮性ネットワークを表します (図 6-2)。後で説明するように、三シナプス経路は初期の宣言的記憶形成の主要な働きを行います。対側海馬 (他の大脳半球からの入力を提供)、扁桃体 (感情内容の追加)、および正中視床核 (内側 PFC からの入力の導管を提供) から海馬ニューロンへの追加の興奮性入力があります。鼻腔内皮質は、歯状回を介した入力に加えて、CAI および CA3 領域の錐体ニューロンにも直接興奮性入力を送ります。最後に、さまざまな CA 領域 (特に CA3 領域) の錐体ニューロンが繰り返し相互に神経支配し、局所ネットワークの興奮力を高めます。これらのさまざまな接続は、皮質やその他の構造が海馬のさまざまな領域と直接通信し、情報を処理する方法に影響を与える方法を提供します。しかし、三シナプス経路は海馬内の情報処理のバックボーンです。他の入力は、このコア モードを大幅に変更および補完します。
処理。
————————図 6-2
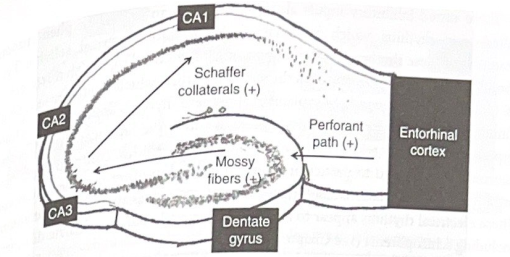
図 6-2 海馬のスライスと三シナプス経路。この図は、海馬の横断面のスライスを示しており、海馬の内部構造と、三シナプス経路を介して嗅内皮質から流れる情報の経路を強調しています。 (+) 記号は興奮性入力を示します。海馬スライスはげっ歯類の脳から調製でき、シナプス経路を維持しながら何時間も生存し続けることができます。これらのスライスは、海馬のシナプス生理学を研究するための準備として好まれています。 (図はセントルイスのワシントン大学の和泉幸敏氏のご厚意によるものです。)
————————
三シナプス経路が記憶形成にどのように関与しているかを調べる前に、今説明したすべての興奮性 (グルタミン酸作動性) ループを調節する何らかのメカニズムが存在する必要があることを理解することが重要です。実際、海馬内の強力な興奮性ドライブにより、ジョン・オルニーが「興奮毒性」と呼んだプロセスを介した過剰興奮による損傷を受けやすくなっています。海馬の過剰な興奮は側頭葉てんかんの発作を引き起こす可能性があり、部分複雑発作の起爆剤として機能します。興奮性の制御を助けるために、海馬には、GABA を速効性抑制性神経伝達物質として使用する一連の介在ニューロンがあります。これらの介在ニューロンは、海馬のさまざまな領域への興奮性入力を調節し、顆粒細胞と錐体ニューロンの出力の制御に役立ちます。現在の研究では、CAI領域だけでも約21種類の異なるタイプの抑制性介在ニューロンが存在することが示されており、この抑制性制御がいかに多様で、複雑で、重要であるかを実証している。さまざまな抑制性介在ニューロンが、主要なニューロンの樹状突起、細胞体、軸索に沿ったさまざまな場所でシナプスを形成し、これらのニューロンが活動電位をどれだけ迅速かつリズミカルに発火させるか、また他の領域からの興奮性入力の有効性を制御するのに役立っています。
これらのさまざまな抑制入力は、電気活動の周期的変動である脳リズムと呼ばれる重要な現象にも寄与します。これらのリズムの 2 つの例は、1 秒あたり約 4 ~ 8 サイクルで変動する海馬のシータ リズムと、1 秒あたり 30 ~ 80 サイクルの速度で変動するガンマ リズムです。後で説明するように、これらのリズムは、海馬内で処理される情報に時間の次元を追加するように見えます。また、さまざまな脳領域内および脳領域全体の活動をリンクしているようで、ニューロンがどのように特定の入力に同調し、より複雑な領域間および領域内の計算を発展させ、覚醒や注意などの現象を引き起こすかに貢献しているようです。これらの電気リズムは、統合失調症を含むいくつかの精神神経疾患で変化しているようです(第 5 章を参照)。
この議論のポイントは、海馬が皮質からの興奮性入力を処理するように構造的にうまく設計されているということです。ただし、脳のすべての領域に当てはまることですが、興奮の暴走は壊滅的な影響を与える可能性があるため、領域の活動を制御下に保つために抑制と均衡が存在します。高速のグルタミン酸作動性および GABA 作動性の入力に加えて、海馬は、ドーパミン、セロトニン、ノルエピネフリン、アセチルコリンなどの神経調節伝達系からさまざまな重要な入力を受け取ります。これらの遅い伝達物質は、この領域の調子を整えるのに役立ち、ニューロンの発火とグルタミン酸シナプスの有効性に影響を与えます。これらの調節入力は、PFC や皮質の他の領域と同様に、海馬の「注意」を特定の入力や処理タスクに集中させるのにも重要であると考えられます。
海馬システム内で情報はどのように流れるのでしょうか?
海馬が複数のコンポーネントで複雑な記憶を形成するには、いくつかの異なるタイプのデータをリンクする機能が必要です。感情的な情報。出来事の重要性(つまり、顕著性)を扱う情報。イベントの「意味」に関連する情報(PFC に関わる抽象的な解釈を含む)。このようなさまざまな種類のデータは、最初に特定の ICN を介して処理され、次に鼻皮質と呼ばれる皮質領域に送られます。これは、海馬への主要な直接皮質接続である嗅内皮質に入力を送信する前に、入力をさらに処理する側頭葉の領域です。鼻皮質には、とりわけ、物が「どこ」に位置するかを決定する経路から情報を収集すると思われる海馬傍皮質と、何かが「何」であるかを決定する詳細を収集する鼻周囲皮質が含まれます。海馬傍皮質と鼻周囲皮質は、それぞれ嗅内皮質の外側(外側)と内側(内側)のサブポーションに入力を送ります。典型的な 6 層皮質の領域である嗅内皮質は、第 II 層ニューロンからの興奮性出力を穿孔経路を介して歯状回に送ります。したがって、回路のこの時点までに、情報は脳の離れた部分から収集され、処理されて、鼻内皮質に送信されます。この部分的に処理された情報は海馬の機構に入り、最終的に宣言を形成する方法で結合されます。
ネイティブな記憶。
————————図 6-3
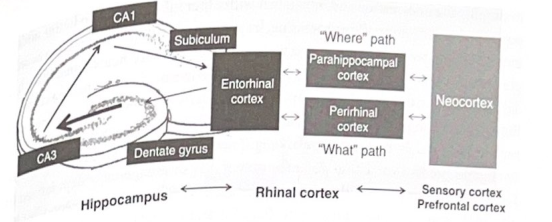
図 6-3 海馬の情報の流れ。この図は、情報がどのように新皮質から鼻皮質および嗅内皮質を介して海馬の三シナプス経路に流れ、海馬台を介して皮質に戻るかを示しています。
————————
情報が穿孔経路を介して歯状回の顆粒細胞に到達すると、CA3 および CAI 領域の三シナプス経路を介して処理できるようになります。三シナプス経路からの出力は CA1 を出て海馬台に流れ、最終的に新皮質に流れ、さらに嗅内皮質に戻ります。嗅内皮質への出力が支配的な経路です。図 6-3 は、海馬への情報の流れと海馬からの情報の流れの概要を示しています。
海馬から嗅内皮質に戻った情報は、鼻皮質および他の領域からの新しい情報とさらに統合されてから、別の情報統合のために海馬に再び入ります。このプロセスは、海馬がその計算結果を皮質にフィードバックできる強力なメカニズムを提供し、嗅内皮質を介した海馬へのその後の入力の調整を含む、他の脳領域での情報統合の調整を可能にします。このループは、海馬内で形成される関連を強化するための重要なツールを提供すると思われます。前述したように、視床正中線や扁桃体などのさまざまな領域から CA 領域への追加の直接接続があります。これらの接続は、三シナプス経路で発生する処理にさらに影響を与えます。ニューラル ネットワーク内でデータがループするというこの概念は海馬に特有のものではなく、皮質-視床-線条体系などの他のシステムにも見られます。
海馬小領域は何をするのですか?
情報が脳のさまざまな領域から三シナプス経路に移動すると、この情報を記憶と呼ばれるものに定着させるために、海馬内のニューロンは実際に何をしているのでしょうか?三シナプス経路のさまざまな構成要素間の構造的関係を利用して、海馬ニューロンは、情報の「微調整」の精巧なシステムを使用して、受け取った入力を処理します。微調整には、大量の情報を取得し、その情報を簡素化して他の情報と統合する方法を決定することが含まれます。この種の情報処理をよりよく理解するために、1 つのニューロンが活動電位を発火し、(グルタミン酸のような興奮性神経伝達物質の放出を介して) 受信細胞が完全に 1 対 1 で活動電位を発火する状況を考えてみましょう。関係。この状況では、情報はセル間で転送されますが、限られた処理のみが行われます。一方、最初のニューロンが部分的にのみ脱分極することで 2 番目の細胞に影響を与え、この 2 番目の細胞が十分に興奮して自身の活動電位を発火させるのは、同時に 3 番目の細胞からの入力によって脱分極した場合のみである場合、情報は単に送信されますが、ある種の処理も受けています。受信セルがさらに下流にメッセージを送信するには、2 つの異なる入力が必要でした。いくつかのセルが連携して別のセルに影響を与えるこのプロセスは、収束と呼ばれます。同様に、3 番目のセルに集まった 2 つのセルのそれぞれも、他の異なるセルに影響を与える可能性があります。このプロセスはダイバージェンスと呼ばれます。三シナプス経路の各タイプのニューロンは、その細胞が活動電位を発火させるためにどの程度の収束入力が必要かという点で、著しく異なる特性を持っています。各セルタイプは、その出力がどの程度拡散するかという点でも異なります。
海馬は計算を実行するために、これらの収束と発散の原理を利用します。げっ歯類の海馬では、具体的な詳細の多くが詳細に解明されており、このモデルを使用して、海馬が情報処理機械としてどのように機能するかを説明します。前述したように、三シナプス経路への入力は嗅内皮質の第 II 層から始まり、歯状回の顆粒細胞にシナプス形成されます。ラットには約 120 万個の歯状顆粒細胞があり、これらのニューロンのそれぞれが約 5,000 個の興奮性入力を受け取ります。これらの 5,000 の収束入力のうち、細胞が活動電位を発火させるためには、約 200 ~ 400 が顆粒細胞を同時に脱分極する必要があります。したがって、嗅内皮質から特定の顆粒細胞への各興奮性シナプスは、比較的弱い影響を及ぼします。顆粒細胞を作動させるには大量の入力が必要なため、歯状回は海馬内の「門番」の役割を果たしていると考えられることもあります。メッセージが強い場合、つまり入力が多くの嗅内ニューロンから同時に到着している場合に限り、情報が海馬の残りの部分に流れることを可能にします。これは、発作のような病的状態の際に、皮質からの過度の興奮性衝撃から海馬を保護するのに役立つ可能性があります。図 6-4 は、海馬内での情報の流れの概要を示しています。
収束と発散は、三シナプス経路の後続の段階でも発生します。ラットのCA3領域には約250,000個の錐体ニューロンが存在します。各歯状顆粒細胞は、約 10 ~ 15 個の CA3 錐体ニューロンと接触します (分岐)。各 CA3 錐体ニューロンは、わずか 3 ~ 5 個の顆粒細胞によって同時に刺激されると活動電位を発火します (収束)。したがって、単一の顆粒細胞が CA3 細胞を引き起こすのに必要な脱分極の最大 3 分の 1 を提供するため、個々の顆粒細胞は CA3 ニューロンに強い影響を与える可能性があります。各 CA3 ニューロンは約 50 ~ 80 個の異なる顆粒細胞から入力を受け取るため、CA3 ニューロンを興奮させるには、個々の CA3 ニューロンの入力の約 5% (50 ~ 80 個の顆粒細胞のうち 3 ~ 5 個) が同時に発火する必要があります。三シナプス経路のさらに下では、約 40 個の CA3 ニューロンが同時に刺激すると、CA1 錐体ニューロンが活動電位を発火します。各 CA1 ニューロンは約 30,000 の入力を受け取るため、それに接続する比較的少数の CA3 ニューロンによってトリガーされる可能性があります。したがって、各 CA1 セルは、多数の入力からの情報を統合する役割を果たします。分岐の点では、各 CA3 ニューロンは約 20,000 個の CA1 細胞に影響を与えることができ、各 CA3 細胞が多くの CA1 細胞に広範囲に影響を与えることができます。 CA1錐体ニューロンは、その軸索(出力)を海馬台、嗅内皮質、さらにはPFCおよび他の皮質下構造に送ります。この議論から、情報を三シナプス経路に取り込むには多大な時間がかかることが明らかですが、一度情報が受け入れられると、システムはその情報を非常に効果的かつ迅速に処理します。
————————図 6-4
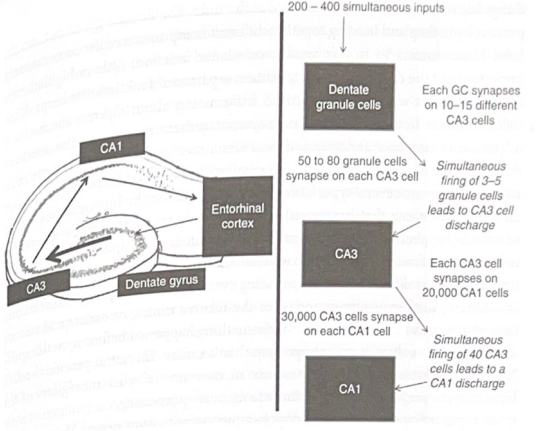
海馬内での収束と発散の原理とその仕組みを強調します。
図 6-4 海馬内の情報の流れ。この図は、海馬の計算に寄与する情報の流れを示しています。
————————
上記の議論は主に齧歯動物の海馬の解剖学と生理学に基づいています。人間の海馬はより大きく、より複雑ですが、全体的な構造とその機能の基礎となる原理は非常に似ているようです。たとえば、ヒトの歯状回には約 1,800 万個の顆粒細胞がありますが、ラットでは 120 万個です。 CA3 野と CA1 野の間の移行は、ヒトの海馬の複雑さの増大が明らかなもう 1 つの場所です。ヒトは CA1 野に CA3 の約 5 倍のニューロンを持っていますが (1,400 万対 280 万)、ラットのニューロンは約 1.5 倍しかありません。 CA1で。この違いにより、人間は CA1 領域の情報がさらに大きく分岐する可能性があります。
海馬は宣言的記憶形成のマスターであり、文脈と新規性に関する情報を結び付けます。何が、どこで、誰が、いつ起こったのか。そしてその時の私たちの内面の状態。歯状回は、同じ記憶の異なるコンポーネントをコーディングして結合することによってプロセスを開始します。 John Lisman はこれを自動連想関数と呼んでいます。記憶のさまざまな要素を区別しておく「パターン分離」機能における歯状回の重要性を強調する研究者もいる。異なるメモリに関する情報は、ヘテロ連想メモリ プロセスの領域 CA3 でリンクされます。これは「パターン補完」機能をもたらし、符号化された記憶の一部が全体の想起につながるメカニズムを提供します。ハワード・アイヒェンバウムは、海馬ではいくつかのタイプの関連が形成されることを強調しています。アイテム(何かが起こった)とコンテキスト(何かが起こった場所)が結びつくと、「出来事」の記憶が生まれます。海馬は、一連の出来事を「エピソード」と呼ばれるものに結び付けることもできます。同様に、イベントはさまざまなエピソード間で共有され、エピソード間のより豊かな関連性が作成されます。さらに、海馬は、出来事の相対的なタイミングと出来事の相対的な重要性、つまり、何かが何かより前に起こったかどうか、ある物事が他の物事よりも重要かどうかをコード化します。この後者のプロセスは「推移的推論」と呼ばれます。表 6-1 は、海馬のどの部分領域が記憶処理に寄与していると考えられているかの概要を示しています。
生理学的意味では、海馬は独自の神経「言語」を使用して情報を処理します。海馬の処理が他の脳領域に役立つためには、他のネットワーク、特に新皮質の高次中枢が理解できる形式に変換されなければなりません。 CAI領域はこれを促進し、CA3からの出力を新皮質によって認識される形式に変換すると考えられます。したがって、CAI は「デコーダ」と呼ばれることもあります。 CA1 はまた、嗅内皮質から直接受け取った入力を分析し、その情報を CA3 野から受け取った処理された情報と比較する能力もあります。したがって、CA1は「不一致検出器」としても役割を果たし、皮質からの入力に対して歯状回およびCA3で実行される処理のチェックとバランスを維持するのに役立ちます。これは、前の章で説明したニューラル エラー検出の一種です。場所を追跡する能力や増分学習の特定の側面など、記憶コーディングの特定の側面も、嗅内皮質からの直接入力とCA3からの処理された入力の両方を使用するCA1のこの能力から恩恵を受ける可能性があります。
————————
表 6-1 海馬の小領域は何をするのか?
歯状回:「パターン分離」ネットワーク
同じメモリの異なるコンポーネントをコード化する
• 事実、文脈、新規性…何を、どこで、いつ?
CA3: 「パターン補完」ネットワーク
ある記憶を別の記憶に結び付けるコードシーケンス
• アイテム + コンテキスト = イベント
• イベント 1 + イベント 2 + … = エピソード
• イベントを別のエピソードにリンク
• 推移的な関連付けをコード化します (A > B >C>D>E)
CA1:「デコーダ」と「不一致検出器」
海馬の表現を皮質の形式に変換します
————————
余談ですが、タイミングは記憶のコンテキストの重要な部分であるため、海馬 (および脳) がどのように時間を追跡するかを考えるのは興味深いことです。この分野は活発に研究されていますが、2 つの要素が重要であると思われます。先ほど、海馬はリズミカルな電気活動(シータリズムなど)を示すと述べました。このようなリズミカルなアクティビティは、新しい入力を解釈するための時間的背景を設定します。別の言い方をすると、データは海馬シータのさまざまなポイントで海馬内で処理され、周期的に発生するネットワーク活動の段階的な変化を伴う時間を追跡し、これが潜在的な時間的組織化原理を提供します。別の方法としては、時間の経過とともに変化が構造全体にわたって波状に進行し、一部の科学者が海馬内に「タイムゾーン」と呼ぶものを作り出す可能性があります。したがって、コンテキストの表現は時間の経過とともに変化する可能性があります。一部の科学者は、この概念を「入力が同じ海馬に二度入ることはない」という概念に例えています。覚えておくべき主な点は、記憶につながる情報の処理には、接続の収束と分岐、海馬の位置で直接的または間接的に分岐する情報の比較、電気回路内で時間の経過とともに発生するリズミカルな変化など、いくつかの生物学的メカニズムが関与しているということです。この素晴らしい脳構造の機能。
私たちは、宣言的(明示的)記憶における海馬の役割と、構造内のサブ領域が情報を処理する方法を強調し、比較的単純な構造内であっても非常に複雑であることを強調しました。三シナプス経路は、海馬の横方向の解剖学的構造と、入力が構造に出入りする方法に基づいています。海馬は背腹軸(上から下)に沿って異なる組織を持っていることを指摘することも重要です。背側海馬(中隔核に最も近い部分)は、認知データ(空間記憶、方向感覚、ナビゲーション、探索など)の処理に特化しているようですが、腹側海馬(側頭皮質に最も近い部分)は、扁桃体、側坐核、辺縁下島皮質とのつながりがあり、特に感情的な記憶の処理に役割を果たします。感情が経験された文脈。腹側海馬は、意欲的な行動、自律機能、神経内分泌状態、特にストレスホルモンの放出を調節するのにも役立ちます。したがって、海馬は単なる認知装置ではありません。それは心のあらゆる側面を統合するために重要であるようです。背側と腹側の区別はげっ歯類の海馬に関係していることを指摘しておく必要があります。人間は、脳内の海馬の位置の違いを反映して、構造の前後 (前から後ろ) の側面に沿って同様の機能が分布しているようです。ヒトでは、後海馬はげっ歯類の背部に相当し、前海馬は腹部に相当します。異なる機能を持っているにもかかわらず、背側海馬領域と腹側海馬領域は、複数の目標を比較し、行動の修正措置を開始するために共通の計算セットを使用しているようです。
シナプス可塑性: 海馬はどのように学習するか
思い出は長く続くことがあります。実際、一生続くものもあります。すでに説明したように、記憶を形成するには、脳のさまざまな領域からの情報がリンクされなければなりません。たとえば、前夜の夕食での不穏な会話を思い出すと、言葉、顔、感情の認識に関わる脳領域の活動が結びついています。この情報処理には脳の電気活動の変化が伴います。長期にわたる学習と記憶が行われるためには、脳機能に永続的な変化が起こらなければなりません。ここでは、化学的および電気的変化がどのようにして細胞および構造の変化をコード化し、促進し、長期記憶をもたらすのかについて説明します。
海馬は、すでに説明した回路を使用して宣言的記憶形成の初期段階を処理します。ニューロンレベルでは、長期記憶を発達させる鍵は、「シナプス可塑性」と呼ばれるプロセスの結果として、入力に対する長期的な反応性を変えるシナプスの能力にあります。興奮性グルタミン酸作動性入力が特定のパターンのニューロン入力によって繰り返し活性化されると、その後のこれらの入力に対する反応方法を変化させる(反応を増加または減少させる)能力があります。これらの変化は、ニューロンが自身のシナプス接続を介してネットワーク内の他のニューロンに情報を渡す方法を制御します。このようなシナプス機能の変化は長期間(数時間から数日、またはそれ以上)持続する可能性があり、長期にわたる機能の変化を示しています。変化は持続するため、シナプス記憶の一形態として見なされます。つまり、シナプスは特定のパターンの活性化を経験したことを「記憶」します。したがって、ある時点で特定のレベルのシナプス応答を生成した特定の入力は、後の時点で同じ量の入力に対して増加または減少した応答を与えます。
これらの変化の持続は「シナプス可塑性と記憶の仮説」の基礎となっており、その最も単純な形では、記憶形成中に誘発される活動依存性の長期シナプス可塑性が情報の保存に必要かつ十分であると述べている。これは魅力的なモデルであり、海馬に関する多くの研究を導いています。リチャード・モリスらによって説得力を持って議論されているように、シナプス可塑性が学習と記憶に必要であるという考えはかなりのデータで裏付けられていますが、それだけで十分であるという証拠ははるかに少ないです。したがって、シナプスの変化は学習と記憶にとって重要ですが、記憶は厳密にはシナプス現象ではないようです。それは、複数の脳領域が関与する新たなネットワーク特性である可能性が高くなります。このネットワーク特性は、感覚、運動、感情のメカニズムに関連する脳領域の機能を調整するように機能します。現在の理解には限界があるにもかかわらず、シナプス可塑性記憶仮説は依然としてこの分野の標準であり、長期可塑性は学習の基礎となる神経機構を説明するために利用できる最良のモデルです。
記憶処理に寄与すると考えられている長期的なシナプス可塑性にはいくつかの形態があります。最も注目されている 2 つは、長期増強作用 (LTP) と長期うつ病 (LTD) です。海馬LTPは、1970年代初頭にTimothy BlissとTerje Lomoによって最初に記載されました。その後、その生理学的、細胞的、分子的、遺伝的メカニズム、および行動と学習における潜在的な役割を調べる多くの研究の対象となってきました。海馬のシナプスは容易に LTP と LTD の両方を経験しますが、これらの形態の可塑性は海馬の唯一の特性ではないことを強調することが重要です。これらの形態は脳全体の興奮性シナプスで観察されており、これらが使用依存性の一般的なメカニズムであることを示唆しています。シナプスの変化。例として、第 5 章で概説した乱用薬物への曝露後の腹側被蓋野と側坐核のシナプス変化の記述を思い出してください。また、抑制性伝達における長期の使用依存性変化の証拠もあります。 LTP は、特定のグルタミン酸を使用する経路の短時間の高周波刺激の後に通常観察される持続的なシナプスの増強を指します。穿孔性経路、苔状線維、およびシェーファー側副シナプスはすべて LTP を示します。これら 3 つのシナプスはすべて重要ですが、ほとんどの研究は CA1 シェーファー側副シナプスで行われているため、これらのシナプスにおける LTP を担うメカニズムに焦点を当てます。シナプス可塑性の分子基盤を理解することは重要です。なぜなら、このプロセスの修正は精神医学や神経学の現在および将来の治療法に関連する可能性があり、このプロセスに関与する遺伝子は多くの病気の一因となる候補であるからです。
シェーファー側副路の単一電気刺激により、CA3 錐体ニューロンの軸索上のシナプス前終末からシナプス後 CA1 錐体ニューロンの頂端樹状突起上へのグルタミン酸の放出が引き起こされます。これらのシナプスは主に樹状突起スパイン(シナプス入力を受け取るように設計された樹状突起膜の特殊な出方)上に発生し、グルタミン酸はAMPA受容体として知られる一種の受容体を活性化します。混乱を避けるために、AMPA は単にこれらの受容体を選択的に活性化する合成化学物質であり、受容体の名前を付けるために使用されていることに注意してください。同様に、NMDA は別のクラスのグルタミン酸受容体を選択的に活性化する合成化学物質です。 AMPA 受容体は、リガンド依存性の非選択的カチオン チャネルです (第 3 章を参照)。これは、グルタミン酸の受容体への結合により、脂質細胞膜を横切るタンパク質経路が迅速かつ短時間開かれ、ナトリウムイオンがニューロンに進入し、カリウムイオンがニューロンから出ることを可能にすることを意味します。ナトリウムとカリウムは正に帯電した「カチオン」です。どちらもオープン AMPA チャネルを介して流れることができるため、チャネルは「非選択的」と呼ばれます。ニューロンが静止膜電位(細胞内部が負の膜貫通電圧約 -70 mV)にあるとき、AMPA チャネルが開くと、ニューロンに作用する電気的および化学的勾配の結果としてナトリウムイオンの流入が大幅に促進されます。ニューロン。ナトリウムイオンの侵入により、受信側のCAIニューロンが興奮(脱分極)します。これは、CA1ニューロンが活動電位(ニューロン間コミュニケーションの主要な推進力である「スパイク」)を発火しやすくなることを意味します。 AMPA 受容体を介したシナプス電流の持続時間は非常に短く、数ミリ秒かけてオンとオフを繰り返します。
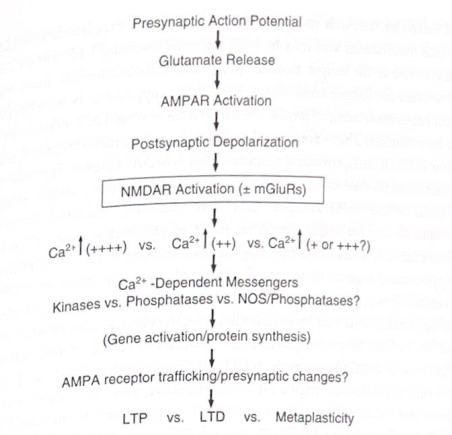
これらの同じグルタミン酸シナプスが、単一の電気刺激ではなく一連の高周波パルス(たとえば、1秒間に100パルス)によって活性化されると、AMPA受容体はCAIニューロンのより大きな脱分極を引き起こします。これは、部分的には、繰り返される緊密なタイミングでの脱分極の合計を反映しています。この脱分極の強化により、別のタイプのグルタミン酸受容体である NMDA 受容体が機能できるようになります。 AMPA 受容体と同様、NMDA 受容体はグルタミン酸によって開かれる非選択的なカチオン チャネルですが、さらに 2 つの重要な特性があります。まず、ニューロンが静止しているとき、それらのイオンチャネルは閉じたままになります。 NMDA受容体は、受容体を収容するニューロンが脱分極した環境でグルタミン酸と結合すると機能するようになります。第二に、NMDA イオンチャネルはカルシウムイオンの透過性が高いです。したがって、NMDA受容体が部分的に脱分極した細胞内のグルタミン酸に結合すると、そのイオンチャネルが効果的に開き、カルシウムイオン(正に荷電した二価[二重荷電]陽イオン)がCA1ニューロンに流入できるようになります。細胞内カルシウムのレベルが上昇すると、CA1 ニューロンの多くの反応が活性化されます。これらの変化には、さまざまな細胞タンパク質にリン酸基を追加するセカンドメッセンジャーとプロテインキナーゼの活性化(「リン酸化」と呼ばれます)が関与し、それによってこれらのタンパク質の機能が変化します(「翻訳後修飾」と呼ばれます)。これらのカルシウム媒介生化学的事象は、LTP の基礎となるシナプス増強の初期段階に関与します。時間の経過とともに、最初のカルシウム シグナル、セカンド メッセンジャー、および誘導された成長因子 (脳由来神経栄養因子 [BDNF] を含む) が CA1 ニューロン内で新しいタンパク質合成を促進し、ニューロンの核内の特定の遺伝子をオンにします。これらの後の出来事は、膜への新しい AMPA 受容体の挿入や、より効果的な処理装置にするためのニューロンの樹状突起の再形成など、グルタミン酸シナプスの有効性と構造にさらに長期にわたる変化をもたらします。特定の種類のプロテインキナーゼ(PKM-ゼータと呼ばれる)がLTP誘導後に持続的に活性化されるという証拠もあり、これもニューロン機能の持続的な変化に寄与しています。これらの化学的現象と構造的現象の組み合わせにより、シナプスの増強が非常に長続きする可能性があるため、LTP という用語が付けられています。図 6-5 は、さまざまな形態の海馬のシナプス可塑性に関連する初期シグナル伝達イベントの簡略化した概要を示しています。
受信側(シナプス後)CA1 ニューロンにおけるこれらの変化に加えて、細胞間の接続に影響を与える別のメカニズムには、活動電位によって CA3 ニューロンの末端から放出されるグルタミン酸の量を変化させるシナプス前変化が含まれます。このタイプのシナプス前増強は、シナプス後ニューロンのNMDA受容体にも依存しており、シナプス後細胞からシナプス前末端に移動し、グルタミン酸放出の増加を可能にする変化を引き起こす「逆行性メッセンジャー」の生成によって生じると考えられています。一酸化窒素 (NO) は、さまざまな細胞で生成される小さく、反応性が高く、拡散性の高い「ガス」であり、この逆行性メッセンジャーの役割を果たすことができる物質の一例です。ニューロン内で長期持続する化学イベントを開始するカルシウムの能力と同様に、NO も細胞内メッセンジャーを介して作用し、シナプス前機能の長期にわたる変化を引き起こすことができます。さまざまな受容体やメッセンジャーを阻害する薬理学的ツールや、重要なタンパク質の発現を変化させる遺伝的戦略を用いた研究は、このような一連の出来事を強力に裏付けています。これらの研究は、LTP がげっ歯類の特定の形式の学習、特に空間迷路学習と恐怖条件付けの文脈的側面に寄与しているという概念も裏付けています。
————————図 6-5
シナプス前活動電位
↓
グルタミン酸の放出
↓
AMPARのアクティベーション
シナプス後脱分極
NMDAR 活性化 (+ mGluR)
↓
Ca2+ 1 (++++) vs. Ca2+1 (++) vs. Ca2+1 (+ または +++?)
Ca2+依存性メッセンジャーキナーゼ対ホスファターゼ対NOS/ホスファターゼ?
↓
(遺伝子活性化・タンパク質合成)
↓
AMPA受容体輸送/シナプス前変化?
↓
LTP 対 LTD 対 化塑性
図 6-5 シナプス可塑性カスケード。この図は、LTP、LTD、および化生の根底にあると考えられるシナプスおよび化学的イベントを示しています。これは、さまざまな形の可塑性を引き起こす分子スイッチとしての NMDA 受容体の重要な役割を強調する、非常に単純化されたスキームです。シナプス後領域に入るカルシウムの量が生理学的結果の決定に大きな役割を果たすことに注意してください。略語: AMPAR (AMPA 受容体)、NMDAR (NMDA 受容体)、mGluR (代謝型グルタミン酸受容体)、NOS (NO シンターゼ)。
————————
興味深いことに、そしてやや驚くべきことに、LTP に関して記載されているイベントの多くは、シェーファー側副経路における LTD にも寄与しています。 LTD は、セルが接続に影響を与える方法に対して異なるアプローチを提供します。ここで、NMDA 受容体の活性化は、シナプス後ニューロンへのカルシウムの流入、セカンド メッセンジャーの活性化、およびシナプス応答の持続的な減少をもたらします。 LTP と LTD の違いは、CAI のシナプスが活性化される方法と、NMDA チャネルを介して流入するカルシウムの量に関係しているようです。 LTDは通常、シェーファー側副入力の低周波刺激を繰り返すことによって誘発されます(例えば、1秒あたり1パルスで10〜15分間の繰り返し刺激)。低くて遅いカルシウムシグナルは、最初は重要なタンパク質からリン酸基を除去し、それらのタンパク質の機能を変えるプロテインホスファターゼを活性化すると考えられます。これは、LTP の初期段階とは逆であるように見えます。しかし、LTP と同様に、LTD の長期的な影響には、シナプスのリモデリングや AMPA 受容体の輸送を伴う新しいタンパク質の合成や遺伝子発現が含まれます。学習における LTD の役割を裏付ける証拠は LTP ほど説得力がありませんが、新規学習、一回試行学習、作業記憶の形態において LTD が重要であることを示唆する証拠もあります。 LTD は、シナプス ネットワークを磨く上でも重要であり、LTP と連携して、特定の入力セットと環境条件によってどのシナプスとニューロンが活性化されるかを決定します。
前述したように、ニューロンが過剰に活性化されるのは良くないので、シナプスの増強が必要なくなったとき(例えば、情報が長期間新皮質に伝達された後など)、LTP を逆転させるには LTD のようなメカニズムも重要である可能性があります。ストレージ)。また、海馬は短期間で能力が限られたシステムであるため、シナプスのリセットを助けるメカニズムがあることは理にかなっています。このような機構はいくつかあり、その中には、NMDA 受容体依存性の「ホモシナプス脱力作用」と呼ばれるプロセスに NMDA 受容体が関与する機構も含まれます。 「ホモシナプス」という用語は、最初に強化されたのと同じシナプスの活性化から生じる変化を意味します。リセット機構の中には、海馬への外部入力を必要としないものもありますが(ホモシナプス性減能)、他のリセット機構は、他の脳領域から海馬領域への直接入力、またはニューロンへの他の入力の活性化によってトリガーされる場合もあります(「ヘテロシナプス」減能)。海馬は新しい記憶を形成する接続の作成に関与しているため、海馬の記憶生成機構が時々ベースラインにリセットされる必要があるのは論理的です。
LTP、LTD、およびシナプスをベースラインにリセットする際の NMDA 受容体の役割は興味深いものですが、同じ伝達物質と受容体が同じシナプスのセットを強化したり、抑制したり、リセットしたりできることを考えると、おそらく少し直観に反するかもしれません (図 6-) 5)。ある意味、これらの特徴は倹約の法則を反映している可能性があり、受容体が活性化される方法や受容体が活性化される状況に応じて、1 セットの受容体が異なる形態のシナプス変化を駆動するために使用されます。問題をさらに複雑にしているのは、シナプス入力と受容体の活性化には、LTP、LTD、または脱力作用をもたらさないタイプがあり、NMDA受容体を使用してLTPの誘導を調節するため、LTPの誘導がより困難になるという事実です。このタイプの調節は「メタ可塑性」(「可塑性の可塑性」の一種)と呼ばれ、ストレスの多い状況(例えば、心理社会的ストレスや、低血糖や短期間などの代謝ストレスなど)下で学習がより困難になる可能性のある変化を反映しています。低酸素症)。シナプス可塑性とその調節に寄与する他のクラスのグルタミン酸受容体もあります。これらには、ニューロンのセカンドメッセンジャーシステムを活性化して細胞内貯蔵庫からカルシウムを放出したり、細胞内の特定の化学メッセンジャーの産生を変化させたりする「代謝指向性」受容体のファミリー(第3章)が含まれます。シナプス可塑性については多くのことが知られているものの、人間の記憶形成についてはまだ表面をなで始めたばかりであることは明らかです。また、私たちの議論は CA1 領域におけるシナプス可塑性に重点を置いていることに注意してください。他のグルタミン酸シナプスでも同様の可塑性が観察されますが、異なるメカニズムが使用される可能性があります。この例は、NMDA受容体がLTPにおいて主要な役割を果たしていないCA3領域の苔状線維シナプスで見られます。興味深いことに、対側海馬からのCA3錐体ニューロンへの入力は、CA1領域で説明したLTPとよく似たNMDA受容体依存性LTPを示し、これは単一のニューロンが特定のシナプス入力に応じて異なるメカニズムによって持続的なシナプス変化を経験する可能性があることを示しています。
シナプス可塑性に関するこの議論にはいくつかの重要なポイントがあります。まず、グルタミン酸シナプスは非常に動的な情報変換器であり、いつ、どのように活性化されるかによって決まるさまざまな効果にわたって機能します。第二に、グルタミン酸受容体には多様な種類があり、シナプス機能の媒介と調節に重要な役割を果たしており、その機能を達成するために複数の受容体タイプを持つため、自身の活性を変化させる能力を持っています。これは、隣接する受容体の同時活性の結果として生じる一般原理です。グルタミン酸は、神経伝達物質が脳内でどのように作用するかという点で独特ではありません。第三に、NMDA 受容体はシナプス可塑性にとって非常に重要です。実際、NMDA 受容体は脳の主要な「一致」検出器の 1 つです。 NMDA イオンチャネルが開くには、送信細胞からのグルタミン酸の放出と受信細胞の活性化 (脱分極) が同時に必要です。このような条件下でのみ、NMDA チャネルはカルシウムを細胞に侵入させます。これにより、それらはヘビアン型可塑性(つまり、「一緒に発火するニューロンが互いに配線する」)の理想的なメディエーターになります。
しかし、NMDA 受容体は諸刃の剣です。一方で、それらは学習と記憶にとって重要です。一方、発作、虚血、または低血糖時の NMDA 受容体の過剰な活性化は、カルシウムやその他のイオンでニューロンに過剰な負荷を与え、ニューロン死につながる可能性があります (「興奮毒性」)。したがって、これらの受容体は多大な規制を受けています。たとえば、これらの受容体を活性化するには脱分極とグルタミン酸が必要な理由は、ニューロンが休止しているときに細胞外マグネシウムイオンがイオンチャネルをブロックするためです。ニューロンが活性化(脱分極)した場合にのみ、マグネシウムがチャネルから出て、他のイオンが流れるようになります。また、グルタミン酸結合と脱分極だけでは、NMDA 受容体関連イオン チャネルを開くのに十分ではありません。受容体は、イオン チャネルの開口を促進するために必要な補因子としてグリシン (または D-セリンなどの関連アミノ酸) にも結合する必要があります。これは、この強力な受容体システムに関するさらに別のチェックを提供します。生理学的および病理学的状態における NMDA 受容体の重要性は、現代の神経科学において繰り返し取り上げられるテーマです。これらのチャネルは、フェンシクリジン (PCP)、メマンチン、エタノールなど、神経機能、記憶、行動に重要な影響を与える多くの向精神薬の標的でもあります。
海馬は単独では活動しない
海馬は重要かつエレガントですが、単独では機能しません。海馬は、精神処理と宣言的記憶の形成の基礎となる分散型脳ネットワークの一部です。たとえば、嗅内皮質はこれらのネットワークにおいて重要な位置を占めており、海馬への直接入力源(歯状回への穿孔経路およびCA3およびCA1領域の遠位樹状突起への直接接続を介して)と、海馬の出力のターゲット。したがって、嗅内皮質は重要な中継点であり、皮質のこの領域への損傷は、海馬単独への損傷よりもさらに記憶に悪影響を与えることを示すいくつかの証拠があります。重要なことは、嗅内皮質は、神経交通警官のように、海馬の活動を監視し、海馬の入出力を調節するのに適した位置にあるということである。
海馬はまた、前頭前皮質、中隔核、扁桃体、側坐核、視床の一部(連結核からの入力と内側背側核への出力)、視床下部、乳頭体などの他の脳領域と直接的または間接的に接続しています。対側の海馬。中脳のドーパミンニューロン、脳幹のノルアドレナリン作動性ニューロン、セロトニン作動性ニューロンからの入力は、海馬の機能に対する動機付けおよび覚醒システムに影響を与えます。これらの多様な接続は、海馬が現在の思考、感情、モチベーションに影響を与える方法を提供すると同時に、これらの構造とそのネットワークからの入力を新しい記憶の形成に組み込むことができます。人間の頭蓋内脳波(EEG)記録に基づく最近の証拠は、予期せぬ出来事を符号化し記憶する際の海馬と側坐核の間の興味深い動態を浮き彫りにしている。初期の脳波電位は、新しい刺激にさらされてから約 190 ミリ秒後に海馬で検出されます。これに続いて、側坐核の電位 (刺激後約 475 ミリ秒) が後期海馬電位 (約 482 ミリ秒) に先行します。初期の海馬信号は新規性の検出を反映しているように見えますが、側坐核信号は期待と顕著性に関する入力を提供しているように見えます。後期海馬電位は、イベントの符号化が成功したことを示します。これらの結果は、学習中の認知システムと動機付け(顕著性)システムの間の相互作用の重要性を浮き彫りにしています。
海馬は宣言的記憶における役割に加えて、デフォルト システム (特定のタスクに集中していないときに脳内で最も活発になるシステム) を含む他の ICN のノードとしても機能します。したがって、海馬が「休む」機会を得られる可能性は低いと思われます。海馬は、その高い接続性と可塑性の高い性質により、その「学習」を利用して安静時の脳の活動を彫刻し、他のネットワークの接続性に影響を与えるのに適した位置にあります。
睡眠と海馬
海馬は決して休まないという概念は、認知処理における睡眠の役割を考えるときに、より具体的な重要性を帯びてきます。睡眠中でも海馬は活発に活動しています。睡眠覚醒サイクルと睡眠の特定の段階は、記憶機能に関与する皮質と海馬の相互作用において非常に重要であると考えられます。起きている間、私たちは継続的に情報を取り入れており、海馬は非常に活発です。私たちが他のタスクを行っていないときでも、海馬は(デフォルトのネットワークの一部として)自伝的記憶を処理し、将来の活動を検討しています。このような処理は多くのエネルギーを消費し、すでに概説したシナプス可塑性メカニズムが関与している可能性があります。しかし、最終的には、海馬はその情報を新皮質に送信し、さらなる処理のためにシナプスをリセットする必要があります。この側面では睡眠が役割を果たしているようで、睡眠中に海馬が覚醒学習中に活動していた回路を再生するという証拠がある。このプロセスは皮質の記憶保存にとって重要であり、睡眠の中断は最近学習した情報やその後の新しい情報の学習に悪影響を及ぼします。この点では、徐波睡眠または深い睡眠(SWS)が特に重要である可能性があります。睡眠中に記憶がどのように処理されるかについての詳細は完全には明らかではありませんが、SWS中に海馬が皮質にメッセージを送信しているようです。 SWS 中のこの通信には、CA3 ニューロンのバースト発火からなる「鋭波リップル」活動が含まれます。これらのバーストは、細胞外の電気活動の鋭い波を生成し、その後、CA1 ニューロン内で非常に高い周波数 (1 秒あたり 200 サイクル) のリップル振動が発生します。これらの鋭い波紋は、海馬が睡眠を利用して覚醒中に学習した出来事を再現する生理学的兆候である可能性があります。これらの波は皮質に影響を与え、SWS 中の PFC ニューロンの活動の変化に先行します。
この鋭い波紋活動は、さまざまな形の新しい情報の学習を助けるために海馬によって使用される重要なツールである可能性があります。興味深いことに、ラットが自分の行動に対する報酬を受け取る期間の後に短波の波紋が発生します。これは、モチベーションが学習を調整し、報酬を受けた行動の想起を強化するさらなるメカニズムを提供します。学習中の海馬、特に CA1 領域の初期変化は、おそらく他のさまざまな脳領域に役立つ形式で信号をパッケージ化します。海馬の鋭波の波紋活動は、この情報を脳のより遠位の部位に送り出し、メッセージが十分な頻度で再生されるようにするメカニズムの 1 つである可能性があります。
他の脳領域によって学習されます。
SWS は、海馬から皮質への情報伝達に関与していることに加えて、シナプスの恒常性にとっても重要である可能性があります。これがどのように起こるかは定かではないが、SWS中の皮質と海馬のコミュニケーションは、高等中枢が海馬の小領域に将来の学習サイクルに備えてシナプスをリセットするよう指示する方法である可能性があり、これはおそらくデポテンシエーションを介して行われる可能性がある。また、SWS は、覚醒中の激しいシナプス処理によって枯渇したエネルギー供給を回復することにより、シナプスのリフレッシュに貢献する可能性があります。このプロセスには、グリア細胞におけるグリコーゲンの合成が含まれる可能性があります。グリコーゲンは、ニューロンが必要とするときに分解してグルコースとして使用できる燃料です。脳内の供給量は非常に限られており、実際にそれを貯蔵しているのはアストロサイトと呼ばれる特定のグリアだけです。グリコーゲンレベルは覚醒中に枯渇します。 SWS中、星状細胞のグリコーゲンレベルは回復します。
記憶における急速眼球運動(REM)睡眠の役割は、あまり理解されていません。レム睡眠中、皮質は海馬からのメッセージを再編成しているようで、海馬と皮質の間の活動には一般的な断絶が存在する(あるいは、少なくとも構造間での活動の調整ははるかに鈍化している)。この断絶が、主にレム睡眠現象である夢がしばしば記憶に残らない理由である可能性があります。海馬はほとんど制御の外にあり、記憶の形成を助けることができません。
多くの精神疾患は睡眠と覚醒のサイクルを混乱させるため、これらの所見は臨床的に重要です。この混乱は認知障害の一因となる可能性があり、またおそらく、繰り返される思考や記憶に対処する困難など、認知障害の他の症状の一因となる可能性があります。たとえば、SWS、特に最も深いレベル(ノンレム睡眠のステージIIIおよびIV)が大うつ病では中断されるという証拠があります。これは、うつ病患者の REM 潜時が短縮されるという発見の主な原因です。したがって、SWS に欠陥があると、シナプスのエネルギー供給、シナプスのリセット、記憶の固定化に問題が生じる可能性があります。これをさらに悪化させるのが、多くの向精神薬がレム睡眠を抑制し、ステージ IV の睡眠にも悪影響を及ぼすことです。
ブプロピオン、ミルタザピン、ネファゾドンを除いて、ほとんどのサントはレム睡眠を減少させます。ミルタザピンとブプロピオンは、睡眠構造(REM と SWS の両方)に最も好ましい効果をもたらす抗うつ薬の 1 つです。
神経新生(新しいニューロン)と海馬
最近の神経科学における最も驚くべき希望に満ちた話の 1 つは、成人の脳で新しいニューロンが生成されるという発見です。これにより、脳の可塑性に対する新たな道が開ける可能性が高まります。成鳥における新しいニューロンの誕生を示すデータは 30 年以上前に記載されていましたが、従来の通念では、それは高等種ではおそらく起こらないと考えられていました。過去 10 年間にわたり、げっ歯類から人間に至るまでの哺乳類でも神経新生が起こることを示すかなりの証拠が蓄積されてきました。哺乳類では、嗅覚系の側脳室の脳室下帯と海馬歯状回の顆粒下帯という 2 つの脳領域が明らかに神経新生を示します (図 6-6)。歯状回では、約 2,000 個の既存のニューロンごとに、毎日約 1 個の新しいニューロンが誕生すると推定されています。したがって、げっ歯類では毎日約 1,000 ~ 3,000 個の新しいニューロンが生まれます。数週間かけて、これらの新しいニューロンは、機能する成体ニューロンの特性 (たとえば、活動電位を発火させたり、シナプス信号を送受信したりする能力) を発達させることができます。新しいニューロンが発達するにつれて、歯状回の回路に侵入し、シナプス伝達とシナプス可塑性に寄与します。
これらの新しいニューロンの発達と機能は、かなりの研究の対象となっています。現在の証拠は、新しいニューロンが海馬が新しさに対処するのを助ける基質を提供する可能性があることを示唆している。実際、これらのニューロンには以前の「履歴」がないため、処理の観点からはほとんど白紙の状態です。また、追加のコンピューティング能力を供給することで、より複雑な受信情報に対処するためのメカニズムである可能性もあります。興味深いことに、新しいニューロンは、動物の生涯の特定の時期に存在するため、新しい情報の処理にタイムスタンプも提供します。新しいニューロンの生成と発達を促進または阻害する因子は、神経新生が精神医学にとって潜在的に重要であることを示しています。例えば、年齢、ストレス、糖質コルチコイドホルモン(コルチゾール)、および多くの薬物乱用は神経新生を損なう一方、運動、カロリー制限、学習は神経新生および/または新しいニューロンの生存を増加させます。興味深いことに、(すべてではないにしても)多くの種類の抗うつ薬および電気けいれん発作(電気けいれん療法[ECT]によって引き起こされる発作と同様)も歯状神経新生を増加させ、これらの治療の有益な効果に共通の基盤を提供する可能性があります。抗うつ薬の神経新生効果は、抗精神病薬、鎮静薬、アヘン剤には模倣されず、ある程度の特異性があることが示唆されます。このトピックについては、次の章で精神疾患における海馬の機能不全について説明するときに再び取り上げます。図 6-6 は、歯状回における神経新生に影響を与える要因の概要を示しています。
————————図 6-6
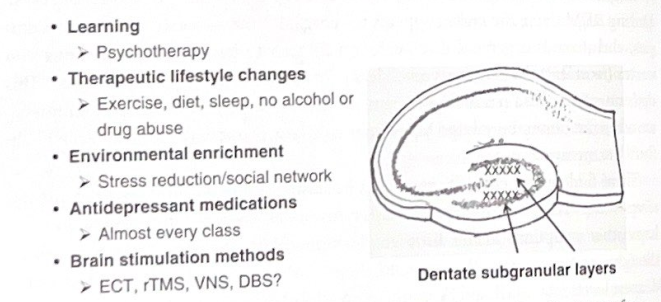
図 6-6 神経新生と精神医学。うつ病のさまざまな治療法を含む多くの要因が、歯状回の神経新生に影響を与えます。この図は、海馬で新しいニューロンが生まれる歯状回の顆粒下領域の位置を強調しています。略語:ECT(電気けいれん療法)、rTMS(反復経頭蓋磁気刺激)、VNS(迷走神経刺激)、DBS(脳深部刺激)。
————————
情報の流れ: 再現
議論のこの部分を終えるにあたり、ゲイリー・リンチとリチャード・グレンジャーが著書『ビッグ・ブレイン』で提供した非常にシンプルだが有用な説明を借りて、脳内の情報の流れを簡単に概観します。私たちが刺激に遭遇すると、感覚からの入力が視床に入ります。視床は、データの流れの皮質下の中継点として重要な役割を果たし、覚醒と睡眠の基礎となる皮質の電気的リズムを生成するのに重要な領域です。視床から、情報は高次中枢による初期処理のために一次感覚皮質に送られます(第 4 章と第 5 章で説明するように、扁桃体にも送られます)。これらは、「ポイントツーポイント」データを迅速に送信する非常に単純な回路であり、データ解釈よりもデータ収集に特化しています。さらに、情報は視床から直接、または一次皮質から、少なくとも 4 つの主要な処理システムに並行して送信されます。 (1) 扁桃体と感情システムは、入ってくる情報の最初の意味と価値 (私たちが経験していることが安全かどうか、それとも私たちに害を及ぼすかどうか) を判断するために活性化されます。このプロセスは、皮質の関与の有無にかかわらず発生します。 (2) 背側線条体が活性化され、必要に応じて運動を開始するための運動システムへのアクセスを提供します。これには、習慣に基づく行動の開始も含まれます。 (3) PFC、視床、線条体の間のループが活性化され、意識的な認識、解釈、行動計画の作成などの高次の処理が可能になります。 (4) 海馬が活性化され、新規性、文脈、偶然性を検出する方法が提供されます。また、宣言的記憶の形成も開始します。海馬は他のシステムにも関与しており、より豊かな関連性をもたらします。
重要なのは、これらのシステムは、必ずしも完全に統合されているわけではないものの、かなりの並列処理を提供することです。処理の一部は同時に行われますが、ループ内で必要なシナプスの数とネットワークが情報を処理する方法に応じて、さまざまな程度の遅延を伴って行われる処理もあります。覚醒、感情、モチベーションの基礎レベルも、情報の処理方法に影響を与える可能性があります。これらのシステム間には、多くの相互接続性もあります。リンチとグレンジャーは、(視床と一次皮質を超えた)高次処理システムをコンピューター用語で「ランダム アクセス」回路と呼んでいます。このような回路では、入力の一部が出力全体を表すのに十分な場合があります。たとえば、小さな情報でも記憶全体を呼び起こすのに十分な場合があります。これは非常に効率的ですが、このタイプの処理は、誤った記憶やイベント中に実際に起こったことの不正確な想起につながるなどの間違いが発生する可能性があります。前に説明したように、エラー訂正の必要性がミックスの重要な部分になります。実際、処理の入力段階と出力段階でエラーを認識して修正する能力は、その人の適切な判断能力と特定の病気に対する回復力を判断するのに役立つ可能性があります (第 5 章を参照)。
————————
留意事項
海馬は記憶の形成に重要であり、宣言的記憶ネットワークの一部です。海馬は、デフォルト システムを含む他の主要な ICN にも貢献しています。
グルタミン酸シナプスは可塑性が高く、この可塑性が学習と記憶に大きく寄与しています。 NMDA 受容体はシナプス可塑性の要であり、精神医学において重要であることがますます認識されています。それらは学習にとって重要である一方で、神経細胞死の前兆となる可能性もあります。したがって、それらの調節は脳にとって根本的に重要な問題です。
海馬の構造と機能の変化は、気分障害、統合失調症、認知症、ストレス関連障害など、いくつかの主要な精神疾患で観察されます。これが、主要な精神疾患が心のあらゆる側面に影響を与える理由である可能性があります。海馬の接続性がそれをほぼ確実にします。
睡眠、特に SWS は精神疾患において非常に重要であり、記憶処理にとって重要な時間です。睡眠と覚醒のサイクルに影響を与える要因は、心のあらゆる側面に大きな影響を与える可能性があります。
神経新生と、認知機能および学習におけるその潜在的な重要性は、精神医学および気分障害の生物学にとって潜在的に非常に重要な領域です。
————————
推奨される読み物
アンダーソン、P.、モリス、R.、アマラル、D.、ブリス、T.、およびオキーフ、J. (編著)。 (2007)。海馬の本。ニューヨーク:オックスフォード大学出版局。
Fanselow、M.S.、Dong、H.-W. (2010年)。背側海馬と腹側海馬は機能的に別個の構造ですか?ニューロン、65、7-19。
カンデル、E.R. (2006)。記憶を求めて: 新しい心の科学の出現。ニューヨーク: WW ノートン & カンパニー。
ルドゥー、J. (2002)。シナプス自己: 私たちの脳がどのようにして私たちになるのか。ニューヨーク:バイキング・プレス。リンチ G.、グレンジャー R. (2008)。大きな脳: 人類の知性の起源と未来。新しい
ヨーク: パルグレイブ・マクミラン。
Zorumski、C.F.、Isenberg、K.E.、Mennerick、S. (2009)。細胞およびシナプスの電気生理学。 B. J. Sadock、V. A. Sadock、および P. Ruiz (編)、カプランとサドックの精神医学の包括的な教科書 (第 9 版、129 ~ 147 頁)。メリーランド州ボルチモア: リッピンコット・ウィリアムズとウィルキンス。
その他の参考文献
アマラル D.G.、ウィッター M.P. (1989)。海馬の三次元組織 Axmacher, N.、Cohen, M. X.、Fell, J.、Haupt, S.、Dumpelmann, M.、Elger, C. E. 他。 (2010年)。頭蓋内脳波は、ヒトの海馬および側坐核における期待と記憶形成と相関します。ニューロン、65、541-549。
形成: 解剖学的データのレビュー。神経科学、31、571-591。
Brun、V.H.、Leutgeb、S.、Wu、H.-Q.、Schwarcz、R.、Witter、M.P.、Moser、E.I.、他。 (2008年)。嗅内皮質からの直接入力の損傷後の CA1 における空間表現の障害。
ニューロン、57、290-302。
ブズサキ、G.、ドラグーン、A. (2004)。皮質ネットワークにおける神経振動。科学、304、
1926年から1929年。
Canals, S.、Beyerlein, M.、Merkle, H.、Logothetis, N. K. (2009)。 LTP 誘発性の神経ネットワーク再構成の機能的 MRI 証拠。現在の生物学、19、398-403。
アイヘンバウム、H. (2000)。陳述記憶のための皮質海馬システム。自然のレビュー
神経科学、1、41-50。
アイヘンバウム、H.、リプトン、PA (2008)。内側側頭葉記憶システムの機能的組織化に向けて:海馬傍および内側嗅内皮質領域の役割。海馬、18、1314-1324。
ガリアルド、A.、イオアレ、P.、サヴィーニ、M.、デルオモ、G.、ビングマン、VP (2009年)。海馬依存性
馴染みのあるエリアマップは、ハトの帰巣中のナビゲーションエラーに伴う修正的な再方向付けをサポートします: GPS 追跡調査。欧州神経科学ジャーナル、29、2389-2400。 Gilestro、G.F.、Tononi、G.、Cirelli、C. (2009)。ショウジョウバエにおける睡眠と覚醒の機能としてのシナプスマーカーの広範な変化。科学、324、109-112。
和泉洋、徳田和、ゾラムスキーC.F.(2008)。低レベルの NMDA 受容体活性化による LTP 阻害には、カルシニューリン、一酸化窒素、および p38 MAP キナーゼが関与します。海馬、18、258-265。和泉 裕、ゾラムスキー C.F. (2008)。直接の皮質入力は、シェーファー側副シナプスの LTP を消去します。神経科学ジャーナル、28、9557-9563。
T.S.G. ジョーンズ (1993)。嗅内と海馬の接続: それらの機能についての推測的な見解。
神経科学の動向、16、58-64。
ケンパーマン、G. (2008)。神経新生予備仮説: 成人の海馬の神経新生は何に役立つのでしょうか?神経科学の動向、31、163-169。
Klausberger, T.、Somogyi, P. (2008)。神経の多様性と時間的ダイナミクス: 海馬の回路動作の統一性。科学、321、53-57。
Lewis, C.M.、Baldassarre, A.、Committeri, G.、Romani, G.L.、および Corbetta, M. (2009)。学習は、休息している人間の脳の自発的な活動を彫刻します。米国科学アカデミー紀要(米国)、106、17558-17563。
リスマン、J.E. (1999)。海馬回路と機能の関係: 歯状-CA3 相互作用による記憶シーケンスの想起。ニューロン、22、233-242。
Lopes Da Silva, F.H.、Witter, M.P.、Boeijinga, P.H.、Lohman, A.H.M. (1990)。大脳辺縁系皮質の解剖学的組織と生理学。生理学レビュー、70、453-511。ルベノフ、EV、シアパス、AG (2009)。海馬のシータ振動は進行波です。自然、459、534-538。
マレンカ、R.C.、ベア、MF (2004)。 LTP と LTD: 富の当惑。ニューロン、44、5-21。
マンズ、J.R.、ハワード、M.W.、およびアイヘンバウム、H. (2007)。海馬の活動の段階的な変化は、出来事の順序を記憶することをサポートします。ニューロン、56、530-540。
Martin, S.J.、Grimwood, P.D.、および Morris, R.G. (2000)。シナプス可塑性と記憶: 仮説の評価。神経科学の年次レビュー、23、649-711。
モール、M.、ボルン、J. (2009)。海馬は深い眠りの中で前頭前皮質にささやきます – 良い思い出を得るために?ニューロン、61、496-498。
I. A. ムッツィオ、C. ケントロス、E. カンデル (2009)。何が思い出されるのでしょうか?海馬表現の符号化と検索における注意の役割。 Journal of Physiology (ロンドン)、587、2837-2854。
中柴 T.、ビュール D.L.、マクヒュー T.J.、利根川 S. (2009)。海馬の CA3 出力は、波紋に関連した記憶の再活性化と固定化に重要です。ニューロン、62、781-787。中芝 T.、ヤング J.Z.、マクヒュー T.J.、ビュール D.L.、利根川 L. (2008)。シナプス伝達のトランスジェニック阻害は、海馬の学習におけるCA3出力の役割を明らかにする。科学、319、1260-1264。
オルニー、J.W. (2003)。興奮毒性、アポトーシスおよび精神神経障害。薬理学における最新の意見、3、101-109。
Peyrache, A.、Khamassi, M.、Benchanene, K.、Wiener, S.L.、Battaglia, F.P. (2009)。睡眠中の前頭前野におけるルール学習に関連する神経パターンの再生。 Nature Neuroscience、12,919-926。
サックター、T.C. (2011)。 PKM はどのようにして長期記憶を維持するのでしょうか? Nature Reviews Neuroscience、12、9-15。
サヘイ、A.、ヘン、R. (2007)。うつ病における成人海馬の神経新生。 Nature Neuro-science、10、1110-1115。
シンガー、A.C.、フランク、L.M. (2009)。報酬を得た結果は、海馬での経験の再活性化を高めます。ニューロン、64、910-921。
ソモギー、P.、クラウスバーガー、T. (2005)。海馬における皮質介在ニューロン構造空間の種類とスパイクのタイミングを定義します。 Journal of Physiology (ロンドン)、562、9-26。 Song, H.、Stevens, C.F.、および Gage, F.H. (2002)。成人の海馬からの神経幹細胞は、機能的なCNSニューロンの必須の特性を発達させます。 Nature Neuroscience、5、438-445。タミンガ、C.A.、スタン、AD、ワグナー、AD (2010)。統合失調症における海馬の形成。アメリカ精神医学ジャーナル、167、1178-1193。
Tononi、G.、Cirelli、C. (2006)。睡眠機能とシナプス恒常性。睡眠医学レビュー、10、49-62。
Van der Werf、Y.D.、Altena、E.、Scoonheim、M.M.、Sanz-Arigita、E.J.、Vis、J.C.、De Rijke、W.、他 (2009)。睡眠はその後の海馬の機能に利益をもたらします。 Nature Neuroscience、12、122-123。
Van Strien, N.M.、Cappaert, N.L.M.、および Witter, M.P. (2009)。記憶の解剖学: 海馬傍 – 海馬ネットワークのインタラクティブな概要。 Nature Reviews Neuroscience、10、272-282。
Wierzynski, C.M.、Lubenov, E.V.、Gu, M.、Siapas, A.G. (2009)。睡眠中の海馬回路と前頭前野回路の間の状態依存のスパイクタイミング関係。 Witter, M.P.、Wouterlood, F.G.、Naber, P.A.、Van Haeften, T. (2000)。海馬傍 – 海馬ネットワークの解剖学的構成。ニューヨーク科学アカデミー年報、Neuron、61、587-596.911、1-24。
ゾルムスキー、C.F. (2005)。神経生物学、神経新生、および精神病理学の病理学。 C. F. Zorumski & E. H. Rubin (編)、『ゲノムと神経科学時代の精神病理学』(175-187 ページ)。ワシントン DC: アメリカ精神医学出版。

