7 ネットワーク機能不全 ストレス、精神疾患、海馬
第 6 章で強調したように、海馬は非常に高い外部接続性と動的な内部構造を備えたノードです。この領域は、デフォルト ネットワークや明示的な記憶形成や感情に関係するネットワークなど、いくつかの固有接続ネットワーク (ICN) の動作にとって重要です。海馬はまた、腹側被蓋野 (VTA) – 側坐核 – 前頭前皮質 (PFC) 経路の動機付け処理システムとも密接に結びついています。
この章では、精神疾患において海馬に何が起こるのか、そして海馬の変化が脳機能全体にどのような影響を与えるのかを考えていきます。私たちはうつ病の研究から得られた証拠を他の精神疾患、特に統合失調症やストレス関連障害の観察と比較します。これらの研究の多くは人間を対象としていますが、心理社会的ストレスのげっ歯類モデルを使用した研究から推定することもします。人間の精神疾患に対する決定的な齧歯動物モデルはないため、この議論の一部は推測になります。それにもかかわらず、多くの脳領域は種を超えて同様の構成を有しており、げっ歯類の研究から得られた洞察は、人間のネットワーク機能不全について考えるときに有益となる可能性があります。これがすでに起こっている領域を指摘します。
海馬の独特の構造と機能、ならびに精神疾患における海馬の役割に関するヒトおよび動物のデータの質と量の結果として、私たちはこの構造を使用してネットワークに関する特定の原理を実証することができます。手術と精神疾患を扱い、細胞、シナプス、ネットワークの変化がどのように共謀して精神症状や病気を引き起こす可能性があるかを強調しています。私たちは具体的な点を指摘するために海馬に焦点を当てていますが、厳密に海馬の機能不全によって媒介される精神疾患はないことを強調します。実際、単一の脳領域が精神疾患の原因となることはありません。これらの病気は、脳ネットワーク内および脳ネットワーク全体の機能不全を反映しています。したがって、複数のリージョンと複数のネットワークが関係する可能性があります。
精神障害と海馬の構造変化
このセクションでは、いくつかの主要な精神疾患における海馬構造の変化を調べた研究を簡単にレビューし、大うつ病で観察される変化に焦点を当てます。すべてではありませんが、構造磁気共鳴画像法 (MRI) を使用した多くの研究で対照の一致が報告されているため、例として大うつ病を使用しています。統計分析を目的とした研究と比較して、うつ病患者では一方または両方の海馬が小さいという多数のデータを組み合わせたメタ分析に基づくと、利用可能なうつ病の構造画像研究が年齢と年齢に関して不均一であることは明らかです。被験者の性別、うつ病の発症年齢、病気の経過、治療に対する反応。この不均一性により、データの解釈がより困難になります。こうした制限にもかかわらず、メタ分析によると、大うつ病患者は双極性障害患者と同様の傾向を示しているが、傾向は同様である。両側の海馬サイズが 8% ~ 10% 縮小するかどうかはまだ明らかではありません。うつ病患者の海馬容積が小さい原因となる特定の海馬小領域の変化を調査した研究はほとんどありません。
うつ病に関する所見を大局的に捉えるには、他の精神神経疾患における所見と比較することが役立ちます。アルツハイマー病の被験者は海馬容積の約 24% の減少を示しますが、軽度認知障害症候群の被験者は約 12% の縮小を示します。統合失調症では、メタ分析では海馬の体積が約5%から7%減少していることが示されており、最近のメタ分析では、心的外傷後ストレス障害の被験者では海馬のサイズが約7%減少していると結論づけられている。したがって、大うつ病における海馬の収縮の程度は、アルツハイマー病や統合失調症よりもはるかに小さいです。いくつかの研究は、うつ病で観察される軽度認知障害や心的外傷後ストレス障害で見られる海馬容積の変化と同様の変化が、海馬に依存した回想の困難を含む顕在的記憶処理の問題と相関していることを示唆している。これは、構造異常と機能的な相関関係があることを強く示唆しています。これらの研究のうち大規模な研究の 1 つは、一般診療環境における 8,000 人以上のコホートからのデータを報告し、うつ病の被験者は陳述記憶に問題があるという考えを裏付けるものでした。他の最近の研究では、うつ病の人は空間ナビゲーションが障害されており、これは海馬機能の異常と相関していると報告されている。
うつ病の被験者で観察される海馬容積の変化が、臨床症状の発症前に起こったのか、それとも病気の経過中に起こったのかを知ることが重要です。臨床症状や機能障害の出現に関する海馬の体積減少のタイミングは研究によって異なります。一部の研究では、欠陥が疾患の初期に存在することを示唆していますが、他の研究では、欠陥が病気の経過を通じて、特に個人が病気のままであるか長期間治療を受けていない場合に発生することを示唆しています。たとえば、上記の大規模な一般実践研究では、宣言的記憶の欠陥は個人がうつ病に陥っていた時間の長さと相関しており、うつ病の状態が記憶機能に累積的な悪影響を及ぼしている可能性があることが示唆されています。これと一致して、Yvette Shelineらは、左海馬容積の変化が女性のうつ病の期間と相関しており、抗うつ薬で治療を受けたうつ病女性は、治療効果が低かったり治療を受けなかったうつ病女性よりも海馬容積が大きいことを発見した。この後者の観察は、回復効果の可能性を高めます。これらの結果はさらに、性質の漸進的な変化を示唆しています。しかし、他の研究では、海馬の萎縮がうつ病エピソードの回数、寛解期間、または入院とは関連していないことが判明しました。これらの影響には性差がある可能性があり、うつ病の最初のエピソードでは、女性ではなく男性の海馬容積が小さいことを示すいくつかの証拠があります。最初のうつ病エピソードの期間は、海馬の大きさを予測しませんでした。一部のデータでは、幼少期に身体的および性的虐待を受けたうつ病のある女性は、虐待歴のないうつ病の女性に比べて海馬が小さいことが示されており、幼少期のトラウマが海馬の発達とうつ病のリスクの両方に影響を与える環境要因である可能性があることが示唆されています。
限られた数の研究だけが精神障害のある被験者の海馬の顕微鏡解剖学的構造を調べており、前述の神経画像データと同様に、これらの研究は矛盾する結果を示しています。うつ病の被験者のシナプスや樹状突起に変化があることを示唆する証拠もあれば、シナプス機能や脳の恒常性を維持するために重要なグリア細胞の一種であるニューロンやアストロサイトの数が減少していることを示唆する研究もある。フランシーヌ・ベネズらは、双極性障害患者11人の死後脳組織を使った研究で、海馬のCA2領域の非錐体ニューロン(GABA作動性抑制性介在ニューロン)の数が約40%減少しているが、ニューロンの数には変化がないことを発見した。錐体(興奮性)ニューロンの数。 CA3 エリアでも同様の傾向が見られました。その後、このグループは、カルシウム結合タンパク質であるパルブアルブミンを発現する高速スパイク CA2 介在ニューロンのクラスにおけるシナプス マーカーの変化を発見しました。第 6 章で述べたように、これらの介在ニューロンは、錐体ニューロンの興奮性と、錐体ニューロンと脳領域の出力と接続を組織化する脳リズムの生成を制御するのに役立ちます。ベネスの研究の結果は、双極性障害やうつ病の可能性がある人では、海馬の内部処理と長距離接続の変化が起こる可能性が高いことを示唆しています。このテーマについては、この章の後半で改めて説明します。重要なのは、構造変化と細胞喪失はうつ病患者の海馬に限定されず、扁桃体、前帯状皮質下(ACC)、外側PFC、および錐体ニューロンを含むニューロンおよびグリアの密度の減少が報告されているということです。眼窩前頭皮質。
精神疾患における海馬の変化の原因
上で概説した研究は、海馬が気分障害、精神病性障害、ストレス関連障害の病理に関与しており、一部の人では病気の発症時に構造変化が存在する可能性があり、一部の人では病気の期間とともに進行する可能性があり、また、ストレスの多い人生経験と関連している可能性があります。したがって、これらの変化がどのように起こるのか、そしてそれらを元に戻すことができるのか、あるいはおそらくは防ぐことができるのかを理解することが重要です。現時点では、動物実験が利用可能なデータの大部分を提供しており、人間への推定は推測の域を出ません。
うつ病や心理社会的ストレスは、有毒な攻撃に対して過剰に秘密にされやすいことに関連しているため、ストレスステロイドが海馬ニューロンの原因因子となる糖質コルチコイドホルモン(コルチゾールなど)の作用によるものであるかどうかを調べることに関心が集まっている。この仮説を裏付けるデータは、げっ歯類の研究から得られています。また、海馬の収縮におけるグルココルチコイドの役割は年齢と一致すると考えられるが、すべての研究ではないが一部の研究では神経伝達物質であり、ニューロンに寄与する興奮毒であるグルタミン酸である。海馬におけるグルタミン酸のストレス関連収縮毒性を媒介する可能性のある物質の 1 つで、多くの神経変性状態におけるストレス損傷間の潜在的な関連性を提供します。グルココルチコイドは興奮毒性を増強します。うつ病におけるグルタミン酸誘導性興奮毒性の役割は、神経細胞の喪失を示す顕微鏡研究と最も一致すると思われる。ニューロンの構造と発育の維持に役立つもう 1 つの相互由来神経栄養因子 (BDNF) は、体積の減少が脳機能などの主要な成長因子の減少を反映しているというものです。病気の病因と治療効果の両方の観点から、気分障害におけるBDNFの役割に関する証拠が増えています。表 7-1 は、うつ病における脳の構造的変化の考えられる原因を示しています。現時点ではこれらすべてが推測であることに注意することが重要です。
精神疾患に関連する海馬の変化が脳の発達の問題を反映しているかどうかを判断することにも関心が集まっています。発達障害には複数のメカニズムが関与している可能性があるが、幼少期のストレス要因(虐待や育児放棄など)や神経毒への曝露の影響は、かなりの研究関心を集めている。発達上の損傷は、一部の人では疾患の発症時であっても、病気の過程の初期に構造変化と細胞喪失を示すデータと一致するだろう。これは、人生の早い段階(小児期および青年期)にこの病気を発症した人に特に当てはまります。このような場合、脳の発達による変化により病気にかかりやすくなる可能性があります。
げっ歯類での研究に基づくと、シナプスが形成される発達期(「シナプス形成」と呼ばれる)は、ニューロンが毒素や薬物への曝露による損傷に対して非常に脆弱な時期であるようです。この影響は、アルコール、抗けいれん薬、全身麻酔薬などの脳活動を抑制する薬剤で最も明確に実証されていますが、鉛などの環境毒素にも及ぶ可能性があります。 John Olneyらは、シナプス形成中に数時間抗うつ薬に曝露すると、げっ歯類の前脳の広範な領域にある数百万個のニューロンを破壊するのに十分であることを発見した。この損傷は、ニューロン (または他の細胞) が自身の生化学機構内で細胞内の「死のプログラム」を活性化することによって自らを破壊するプロセスである「アポトーシス」によって引き起こされます。アポトーシスは細胞の「自殺」の一種をもたらし、これは通常発生中のトーシスによるメカニズムであり、これは体が損傷した細胞や不要な細胞を自ら除去する形成に必要なメカニズムです。一部の細胞はアポトーシスを起こし、健康な脳を調整します。抑制剤(つまり、一部の脳領域の活動において大量の細胞損失(10倍以上)を引き起こすニューロンを阻害する薬剤)は、シナプス形成中に投与されると、このプロセスを大幅に増加させます(図7-1)。興味深いことに、この種の薬物誘発性の発達障害を経験している齧歯動物は、著しい障害を受けておらず、これは同腹子対照と比較して、同様の成長と感覚運動機能を持って青年期および成人期まで成熟することを意味する。しかし、これらの動物は、思春期から成人になるにつれて、学習と記憶、海馬のシナプス機能、そしておそらくストレス反応に欠陥を示します。また、対照同腹子よりもアルコール耐性が高く、急性血中アルコール濃度が非常に高い場合でも行動鎮静が著しく少ないことが示されています。
————————
表 7-1 うつ病における脳の構造変化の考えられる原因
・糖質コルチコイド(ストレスホルモン)
・脳由来神経栄養因子(BDNF)の減少
・グルタミン酸媒介興奮毒性
・発達異常
————————
すでに述べたように、シナプス形成の時期は、哺乳類の前脳が毒素や薬物への曝露によって与えられる損傷に対して非常に敏感な時期です。人間の場合、シナプス形成は妊娠第 3 期から生後の最初の数年間まで続きます。麻酔薬、抗けいれん薬、鎮静薬などの臨床的に使用される薬剤への曝露後にこの種のアポトーシス損傷が発生する可能性があるという当然の懸念があるが、出生前にアルコールに曝露される可能性は高い。
————————図7-1
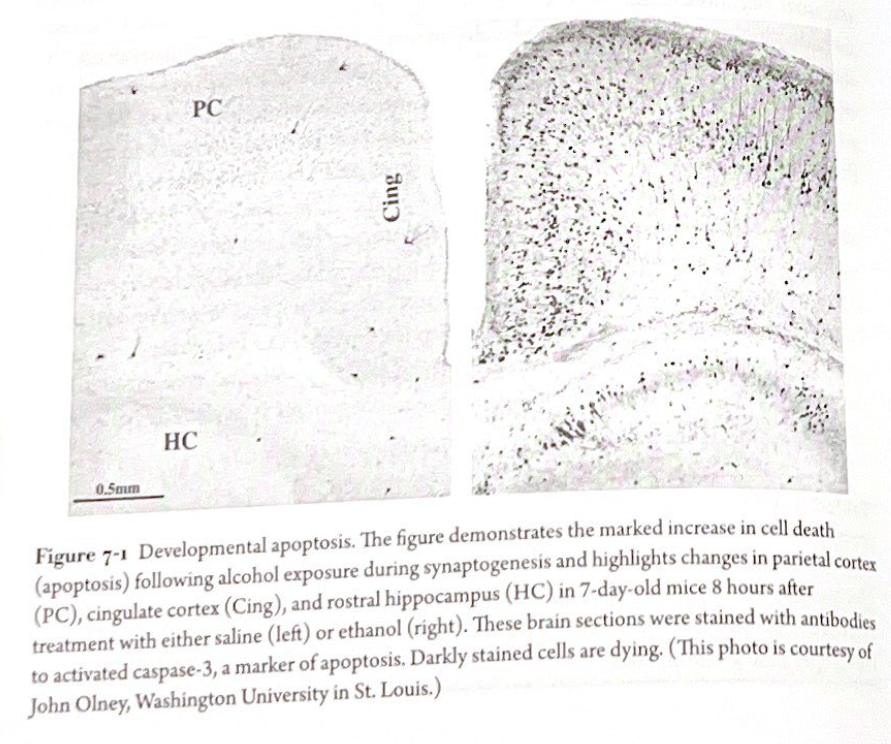
図 7-1 発生時のアポトーシス。この図は、シナプス形成中のアルコール曝露後の細胞死 (アポトーシス) の顕著な増加を示しており、処理 8 時間後の生後 7 日マウスにおける頭頂葉皮質 (PC)、帯状皮質 (Cing)、および吻側海馬 (HC) の変化を強調しています。生理食塩水 (左) またはエタノール (右) のいずれかを使用します。これらの脳切片は、アポトーシスのマーカーである活性化カスパーゼ 3 に対する抗体で染色されました。暗く染色された細胞は死滅しています。 (この写真は、セントルイスのワシントン大学、ジョン オルニー氏のご厚意により提供されました。)
————————
一般人口の観点から見て最大のリスクを表します。さまざまな動物種でアポトーシスを引き起こすのに必要なアルコールの量を調べた研究に基づくと、妊婦が数時間かけて適量を飲酒すると、中毒レベルに達する可能性が高いことがわかっています。子宮内エタノール曝露は、関連する精神発達遅滞を引き起こします。認知機能への影響に加えて、非家族性精神疾患(うつ病、精神病、薬物乱用)の最も一般的な原因の1つである胎児性アルコール症候群が成熟するにつれて、胎児性アルコール症候群を患っている人が発症する可能性があることがわかります。大成人になるリスクが高まっています。さらに、PFCの最高脳中枢の発達は、思春期後期または成人期初期まで完了しない可能性があり、薬物乱用の初期または薬物曝露が始まった場合でも、アポトーシス機構を介した高レベルの認知が行動に悪影響を与える可能性がある可能性が高まっています。薬物曝露が青年期に始まった場合でも、アポトーシスメカニズムを介した気分、高レベルの認知。
ストレスを受けた海馬: 動物モデルからの教訓
海馬の構造の変化がどのようにして機能不全を引き起こし、うつ病やその他の精神疾患につながるのかを研究することは困難です。前述したように、動物、特にげっ歯類での実験は、情報がどのように発生するかについての重要な手がかりを提供することができ、人間の三シナプス経路内で情報がどのように流れるかを明らかにしました。第 6 章では、海馬がカール・ダイセロートを通常どのように処理するかを検討し、同僚らはラットを軽度のストレスの繰り返しの発作にさらした。 (図7-2)。ラーグ・アイラン氏は、海馬の機能に対するストレスの影響を研究するために、明暗サイクルの変化、寝具の湿り気、ホームケージ内の物体の移動などをストレッサーとして挙げた。数週間にわたって、ラットは毛づくろい行動や糖質コルチコイド分泌の変化など、ストレスの生理学的兆候を示した。ストレスにさらされた後、動物は強制グルココートで研究されました。このテストは、「うつ病のような」行動を検出するためのげっ歯類モデルとして使用されます。
————————図 7-2
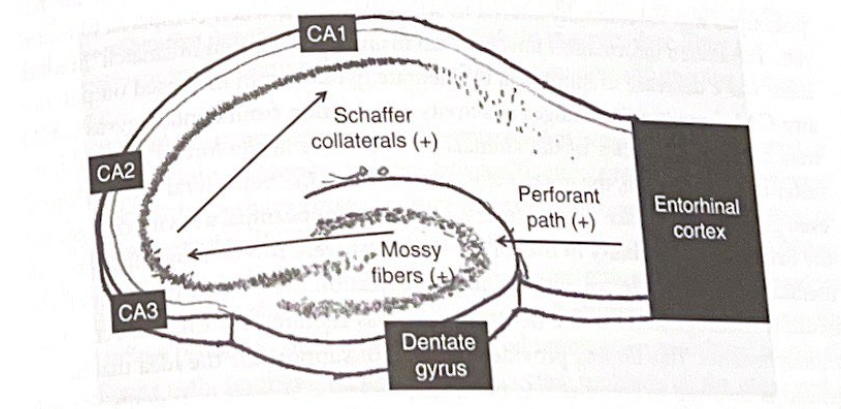
図 7-2 海馬のスライスと三シナプス経路。この図は、嗅内皮質から歯状回および三シナプス海馬経路への情報の流れを示しています。
————————
ストレスを受けたげっ歯類は、ストレスを受けていない動物よりも早くこのテストで諦めて動けなくなる傾向があります。抗うつ薬がこのモデルの水泳時間を増加させることは長い間知られており、そのため、潜在的な新しい抗うつ薬を特定するための実験的方法として強制水泳テストが使用されるようになりました。 Deisseroth の研究では、慢性的な軽度のストレスにさらされたラットは、対照と比較してより大きな不動性を示し、ラットが「抑うつ」表現型を持っていたという考えを裏付けました。
これらの発見は、慢性ストレスとうつ病の他のラットモデルと一致しています。 Deisseroth グループの研究がユニークなのは、これらの研究者がストレスを受けたラットとストレスを受けていないラットの腹側海馬から脳スライスを調製し、海馬内の活動の流れを監視するために高速電位感受性色素 (VSD) を使用して海馬の機能を検査したことである。海馬スライスは、げっ歯類から海馬を解剖し、通常 200 ~ 500 μm の厚さの横断切片に切断する in vitro 標本の一種です。これらの脳切片は何時間も生存し、歯状回への穿孔経路入力、CA3 への苔状線維入力、CA1 へのシェーファー側副入力を含む、第 6 章で説明したグルタミン酸を使用する三シナプス経路全体を維持します (図 7 を参照)。 2)。この準備は 30 年以上にわたって海馬の生理学を研究するための標準的な方法でした。 Deisseroth 研究の興味深い特徴は、海馬を通る電気活動の流れを監視するために VSD を使用したことです。 VSD は細胞膜と相互作用し、細胞膜を横切る電圧変化に応答して光を発する蛍光分子です。グルタミン酸経路の刺激は、受信ニューロンの脱分極 (興奮) を引き起こします。この脱分極は、VSD による発光の変化を伴い、特殊な顕微鏡を使用して検出できます。実際、VSDS は細胞レベルで一種の機能的神経画像処理を提供します。脳の領域が興奮すると、光が放射され、その光の強度と広がりの程度を定量化し、分析することができます。 VSD の使用と結果の解釈には実験上の限界がありますが、この方法は脳領域内および脳領域間の活動の浸透を研究するための最先端の方法です。
Deisserothらは、ストレスを受けたげっ歯類では、対照ラットと比較して、海馬を通じた活動の伝播が大幅に変化していることを発見した。情報の流れの変化により、歯状回を介した入力が減少するが、CA1領域からの出力が増加する「入力と出力の不一致」が生じた。重要なことに、歯状からの活動の伝播の変化は、強制水泳試験における動物の成績の信頼できる予測因子でした。伝播が低いほど、行動試験における不動性が大きくなります。おそらく精神医学にとってさらに重要なことは、強制水泳テストにおける海馬活動の変化と行動的不動の両方が、抗うつ薬によって回復したが、抗精神病薬によって回復しなかったということである。さらに、抗うつ薬のこれらの効果には、歯状回での新しいニューロンの誕生(神経新生)が必要でした。この発見は、少なくともげっ歯類においては、神経新生が抗うつ薬の一部の効果に関与しているという考えを裏付ける一線を提供する。このトピックについては、この章の後半で改めて説明します。図 7-3 は、これらの発見の概略図を示しています。
————————
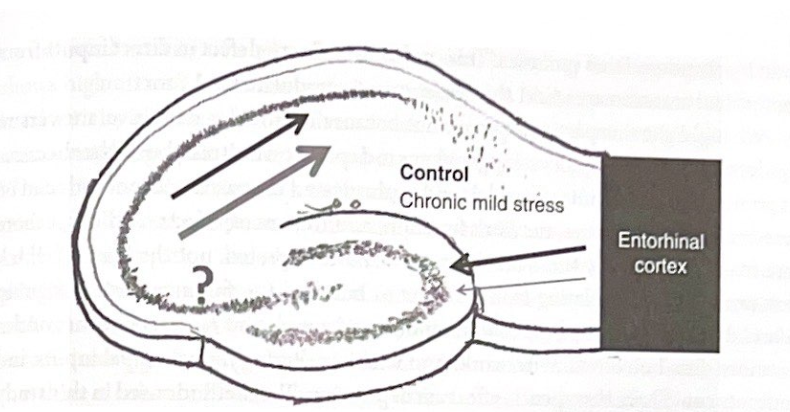
図 7-3 海馬の入力/出力の不一致と慢性的な軽度のストレス。この図は、慢性的な軽度のストレスが海馬機能に及ぼす影響を調査した際に、Airanらによって発見された変化を示しています。行動ストレスにより、歯状回への流入が減少する一方、CA1領域からの流出が増加するという入出力の不一致が生じた。
————————
入出力の不一致は海馬の情報処理にとって何を意味するのでしょうか?この質問に対する答えは推測の域を出ませんが、既知の海馬の生物学に基づいて合理的な仮説を立てることができます。流入の減少は、海馬が新しいデータを消化し、皮質からの新しい入力を新しい記憶に変換するのに問題があり、その結果、一種の学習欠陥が生じていることを示唆している。同時に、CA1領域を介して海馬から皮質に戻る出力が強化され、海馬回路にすでに保存されている「古い」情報が繰り返し皮質に送信されていることを示唆しています。この組み合わせは、更新された学習が減少するため、海馬がエラーを修正するのに問題を抱えている可能性があることを示唆しています。このシナリオでは、海馬から皮質に送られるメッセージにストレス関連の記憶や文脈上の恐怖が繰り返し含まれる可能性があります。過度に単純化した解釈かもしれないが、この入出力の不一致は、うつ病やストレスを抱えた患者は、再発するうつ病の思考を頭から追い出すのに苦労し、自分を納得させるような新しい知識を取り入れるのが難しいという臨床結果に関連している可能性もある。彼らの反復的な否定的な思考は不正確または不適切であると考えます。また、彼らは、人生の中で新しく進行中の出来事に憂鬱な記憶を組み込む傾向があります。
海馬の入出力障害がどのようにして起こるのかは不明です。歯状レベルでは、入力の伝播の失敗は、おそらく長期増強(LTP)、ストレス誘発性の化生、または歯状顆粒の過剰な阻害に寄与するメカニズムの欠陥に起因する、長期的なシナプス可塑性の問題を反映している可能性があります。細胞。ストレスとグルココルチコイド分泌は、LTP 誘導を妨げ、一部の脳領域の抑制性緊張を変化させることが知られています。あるいは、歯状流入の問題は、穿孔経路を介した嗅内皮質からの入力の減少を反映している可能性があり、上流の処理の問題を示唆しています。三シナプス経路のもう一方の端では、CAI野からの持続的な出力は、おそらく以前に増強されたシナプスの増強の欠陥を含む、恒常性シナプスのリセットの問題を反映している可能性があります。これは、CA1 機能を調節することが知られている嗅内皮質から CAI 領域への直接入力の欠陥も反映している可能性があります。
私たちがこの特定の研究を強調するのは、この研究がうつ病やストレスにおける神経処理の問題を理解するための決定的な答えを提供するからではなく、動物モデルと高度な神経科学手法を使用して行動、ネットワーク機能、治療効果を調査する方法を示しているからです。これらの結果が過大解釈され得る理由は数多くあるが、その中でも特にげっ歯類からヒトへの推定の問題はあるが、今回の研究結果は、海馬の入出力の変更がより分散型のニューラルネットワーク内の他のノードにどのような影響を与えるのか、また、海馬の入力と出力を変更すると、うつ病に治療効果がある可能性があります。この研究で使用された方法は、電気けいれん療法、経頭蓋磁気刺激、脳深部刺激などの脳刺激法の効果を解明するのにも役立つことが証明される可能性があります。同様に、この種の研究は、学習(心理療法)やライフスタイルへの介入(睡眠衛生と運動)がうつ病にどのような有益な効果をもたらすかを理解するのにも役立つ可能性があります。
第 6 章で述べたように、海馬は単独で機能するわけではないため、海馬の機能の変化がより分散されたニューラル ネットワークにおける情報処理をどのように変化させるかを理解することが重要です。ジョシュア・ゴードンの研究室は、人間の病気のマウスモデルを使用して、不安や精神病に関連する遺伝子異常が海馬とPFCの間の活動の同期をどのように変化させるかを調べてきた。セロトニン 1A 受容体が欠失したマウスは、ストレスや不安様の行動が増加し、腹側 (背側ではない) 海馬と内側 PFC を結ぶ同期活動が顕著に増加します。対照的に、統合失調症に関連するヒトの22q11.2欠失に類似した染色体欠失を持つマウスは、作業記憶の障害(統合失調症に共通する認知欠陥)と海馬-PFC活性の同調性の低下を示します。これら後者の研究の重要性は、細胞およびシナプスのメカニズムが領域間処理の問題や精神疾患に伴う脳機能の高次欠陥にどのように寄与するかを理解するための基礎を提供することです。
気分障害および精神障害に関する最近の人間に関する研究
前述したように、大うつ病患者で報告されている海馬構造の変化は、記憶処理の問題と関連しています。これらの発見だけでも、うつ病は単なる感情機能障害ではなく、認知の問題が気分障害の主な原因であるという考えを強く裏付けています。残念ながら、構造画像研究では、うつ病患者の海馬内やうつ病に関係するネットワーク内で何が起こっているのかについては何もわかりません。安静時および認知作業中の人間の脳の機能的接続性の画像化の進歩により、これらの問題のいくつかが解明される可能性が期待されます。
まず、デフォルト モードの ICN 内での処理に何が起こるかを検討します。以前に説明したように、デフォルト モード ICN は、海馬を含む脳領域のグループの協調的な活動を反映しており、脳が特定のタスクを行っていないときに高い活動を示します。この高い基礎活動には、気分、自伝的記憶、抽象的な思考、そしておそらくは将来の計画など、個人内の情報への注目が含まれていると考えられています。注意がタスクに移ると、タスク指向の ICN がオンラインになるため、デフォルトの ICN のアクティビティは減少します。さまざまな精神疾患を患う患者は自分自身の思考や内なる世界に夢中になる傾向があるため、デフォルトモードの処理の欠陥がこれらの疾患に関連しているかどうかを判断することに大きな関心が寄せられています。データはまだ暫定的なものですが、うつ病の人はデフォルトモードの活動に重大な問題を抱えているようです。いくつかの証拠は、ネットワーク内、特に膝下ACCと特定の視床核との間の基底結合性が強化されており、この結合性の強化が現在のうつ病エピソードの持続時間と相関していることを示している。うつ病の人は、特定のタスクを実行するとき、特にそのタスクにネガティブな感情的内容が含まれる場合、デフォルトのモードから抜け出すことが難しいようです。 Yvette Shelineらは、うつ病の被験者は、負の視覚刺激に対処したときに、対照者に比べて海馬、海馬傍、嗅内皮質、扁桃体の活動が増加していることを発見した。内側 PFC、上側頭回、視床下部、水道周囲灰白質などの他の関連領域も、対照と比較して有意な差を示しました。これらの研究は、うつ病ではデフォルトのシステム内での処理が異常であり、うつ病の人は内部に集中した処理モードに「行き詰まっている」可能性があることを示唆しています。
ヒトと動物の研究を比較するのは常に無理があるが、ベースライン時およびうつ病患者の課題中のデフォルトネットワークの過剰活動は、前述のストレスを受けたげっ歯類での所見と似ていない。そこでは、新しい情報の処理が低下しているにもかかわらず、CAI 海馬の出力は上昇したままでした。海馬と皮質およびデフォルトネットワーク内の他の部位との接続性を考えると、この過剰な海馬の出力は、海馬から入力を受ける領域である膝下ACCを含む、デフォルトネットワークの他の領域で観察される過剰な活動の一因となる可能性があります。
うつ病におけるデフォルトネットワーク内の過剰活動の原因は何でしょうか?うつ病の人はなぜデフォルトモードから抜け出すことが難しいのでしょうか?これらの重要な質問への答えは、うつ病やおそらく他の精神疾患の根底にあるネットワークの欠陥を解明するのに大いに役立つ可能性があります。また、これらの異常な状態に入る経路とそこから出る経路が複数ある可能性があり、これらの経路を理解することは、病気をサブタイプ化し、より的を絞った治療戦略を定義するのに役立つ可能性があります。場合によっては、デフォルトの ICN 自体に欠陥が存在する可能性がありますが、他の場合には、他の ICNS の欠陥によりデフォルト モードの機能が変更される可能性があります。最近の研究では、両方の可能性について暫定的な裏付けが提供されています。
ブラッドリー・ピーターソン、マーナ・ワイズマンらは、家族歴に基づいて、大うつ病のリスクがさまざまな程度にある個人を研究した。高リスクの個人には、家族の複数世代にうつ病があったが、低リスクの個人には家族にうつ病の病歴がなかった。 Petersonらは、構造神経画像を用いて、高リスクの人は前頭皮質下および内側、体性感覚および運動野、背側/下頭頂皮質、下後頭葉および後側頭葉皮質を含む広範囲の領域にわたって新皮質が薄化していることを発見した。 、および楔前部/帯状皮質。これらの領域には、デフォルトの ICN の一部であるものもあれば、そうでないものもあります。重要なことに、皮質の菲薄化の程度は、現在のうつ病症状の重症度と、社会的および感情的刺激に対する認知的不注意および視覚的記憶の問題と相関していた。さらに、皮質の厚さは、うつ病、認知的不注意、臨床症状の家族リスクの間の関連性を媒介するようである。著者らは、この慎重に選択されたコホートにおける家族性うつ病リスクは、右(非優位)半球の皮質灰白質の減少に由来しており、その結果、注意を集中することが困難になり、視覚記憶(右半球によって処理される記憶の一種)が困難になると結論付けた。 )。臨床的うつ病を発症した人は、左大脳半球も薄くなっていた。デフォルトの ICN に関して、この研究の興味深い側面は、不注意が気分や不安の症状の強力な予測因子であったことです。タスクに注意を集中させることは、デフォルト モードの処理から抜け出すことに関係していることを思い出してください。したがって、これらの対象に対する不注意がデフォルトモードの処理からの移行に問題をもたらし、おそらく海馬とネットワークの過活動につながったのではないかと我々は推測している。図 7-4 は、Peterson らによって説明された結果の解釈を示しています。
————————
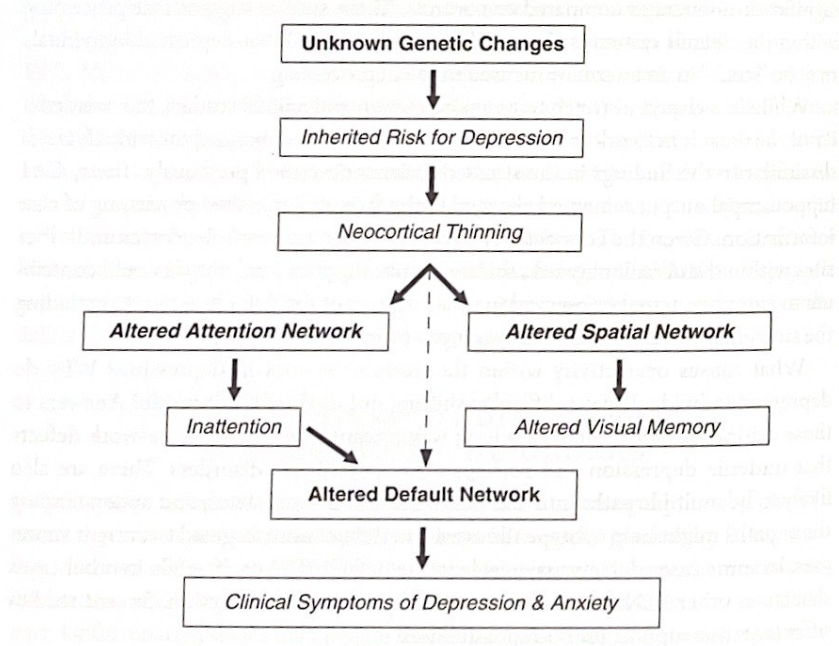
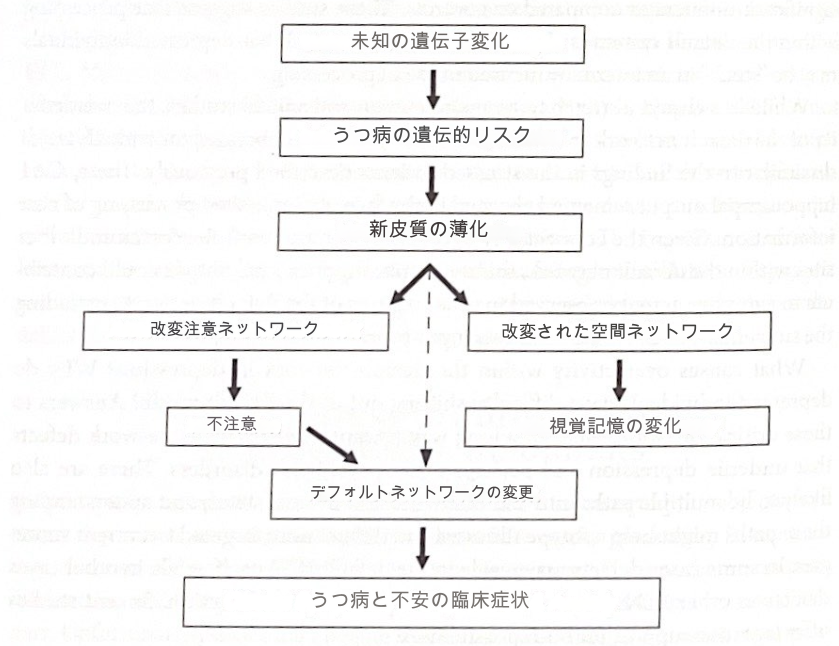
図 7-4 皮質の薄化と陥没。この図は、Bradley Peterson らによって報告された結果の概略図を示しています。家族性うつ病のリスクが高い個人におけるまだ知られていない遺伝的変化は(おそらく環境変数と関連して)新皮質の薄化をもたらします。これらの皮質の変化により、注意の集中や空間記憶の処理に問題が生じます。注意を怠ると、デフォルトのネットワーク処理に問題が発生する可能性があり、うつ病や不安症の臨床症状に関与する可能性があります。
————————
Christine Esslingerらによる別の最近の研究では、機能的ニューロイメージングを使用して、精神病(精神病性気分障害および統合失調症)に関連する遺伝子の一塩基多型(SNP)が機能的な脳の接続にどのような影響を与えるかを調べた。この研究では、目的の遺伝子は、他の遺伝子の発現の調節に役立つ可能性のある未知の機能のタンパク質(ジンクフィンガータンパク質と呼ばれる)をコードしている。この遺伝的危険因子を持たない対照被験者は、左右の背外側 PFC (dIPFC) (作業記憶に関与する領域) の間の強い接続の証拠を示しましたが、右 dIPFC と左の海馬の間の接続は示されませんでした。精神病に関連するSNPを1つ持つ被験者は、病気のリスクが中程度に増加しており、右dIPFCと左海馬の接続性が増加したが、リスク対立遺伝子を2つ持つ(病気のリスクが最も高い)被験者は、dIPFCと海馬の接続性がさらに高かった。同様に、左右の dIPFC 間の接続も低下します。最もリスクが高い被験者は、扁桃体と海馬およびPFC領域との接続性が高まっており、認知処理において感情がより大きな役割を果たすための導管となっていた。私たちは、この研究が少なくとも 2 つの理由から重要であると考えています。まず、精神障害の遺伝的危険因子は、海馬を含む大脳の接続性の変化と関連していた。第二に、接続性の変化は単一の精神疾患に特有のものではなかった。代わりに、彼らは精神病のリスクを追跡し、気分障害と統合失調症の臨床境界を越えました。この発見は、現在の精神医学の表現型をどのように分類するかについて疑問を提起する文献が増えていることに加えます。
病気に関連する回路欠陥を細胞レベルおよびシナプスレベルで理解するには、機能的接続に基づく分析と、脳領域内および脳領域全体で情報がどのように処理されるかを調べる研究を組み合わせることが重要です。神経画像の解像度に限界があり、生理学、細胞、分子の研究には生きた組織にアクセスできないことを考慮すると、これを人間で達成するのは困難である。 Francine Benes らによって使用された別のアプローチは、死後組織における遺伝子発現を研究し、シナプス ネットワークがどのように機能するかについて推論を導くことです。ベネスグループが双極性障害患者では海馬のCA2領域のGABA作動性介在ニューロンの数が減少していることを発見したことを以前に述べました。最近、このグループは、遺伝子発現プロファイリングと組み合わせて特定の細胞を単離する高度に専門化された手順(レーザーキャプチャマイクロダイセクションと呼ばれる)を使用して、双極性障害および統合失調症の被験者の海馬三シナプス経路を調べた。彼らは、異なるサブフィールド(CAI、CA2、およびCA3)の海馬の特定の層における、グルコース代謝、エネルギー産生、細胞周期調節、シナプス機能、および神経新生に関与するカスケードを含む、主要な細胞内生化学カスケードにおける遺伝子発現の変化を分析しました。 。双極性障害の被験者では、CA3/2領域のオリエンス層(錐体ニューロンの軸索が出る層)の介在ニューロンで多くの重要な遺伝子の発現が低下していることを発見したが、この層では遺伝子発現の亢進が観察された。エリアCA1の領域。放射状層(海馬の他の領域からの入力がシナプスを形成する層)の介在ニューロンと錐体ニューロンでは遺伝子発現の変化がより限定的であったが、CA1錐体ニューロンでは代謝および細胞周期遺伝子の発現が増加した。
————————
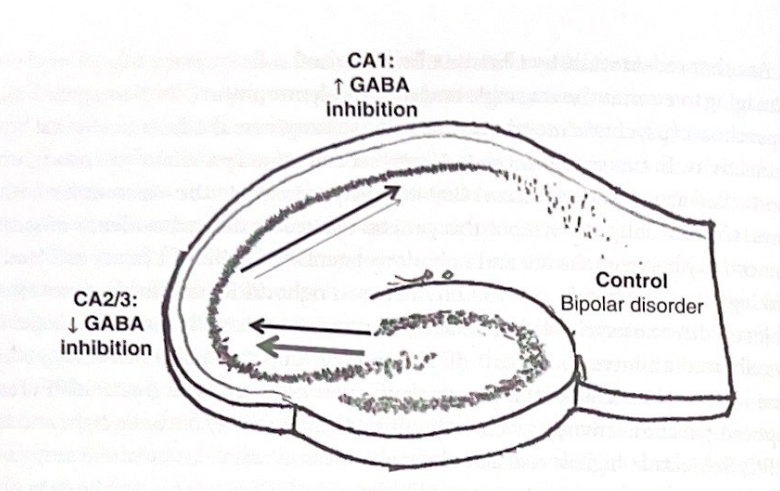
図 7-5 双極性障害と海馬の情報の流れ。この図は、遺伝子発現の変化に基づいて双極性障害患者に対して提案されている海馬の情報の流れの変化を示しています。 (この数字は、Francine Benes らによって報告されたデータに基づいています。)
————————
興味深いことに、統合失調症患者では遺伝子発現のパターンが異なり、CA3/2 と CA1 の両方の層方向の介在ニューロンでの発現が低く、どちらの領域でも錐体ニューロンの変化は限られていた。 これらの観察から、Benes らは、海馬を介したフィードフォワード興奮は、層オリエンス介在ニューロンの活動の増加の結果として、CA1レベルで減衰することを示唆しました。双極性障害のある被験者において。統合失調症では、CA1 介在ニューロンの活動低下により、三シナプスの流れと出力が増加する可能性があります。図 7-5 および 7-6 は、海馬の情報の流れに関する考えられる影響を伴うこれらの結果の概略図を示しています。この研究の強みは、遺伝子発現を調査し、重要なシナプス経路の活性における潜在的な変化を詳細に分析するための洗練された方法の使用です。ただし、Deisseroth らによってげっ歯類で行われた研究とは異なり、このアプローチを使用すると、海馬の情報の流れについて確固たる結論を導くことは、はるかに直接的ではなく、より推測的になります。例えば、双極性障害患者におけるCA1層オリエン介在ニューロンの「活性」の増加が錐体ニューロン発火の減少をもたらすのか、それともこれらの介在ニューロンによる錐体ニューロンの過剰活動を補おうとする試みを表すのかは不明である( CA1錐体ニューロンにおける代謝遺伝子の発現)。それにもかかわらず、この研究は、精神障害を持つ人間のネットワークダイナミクスを理解するために細胞および分子の方法を使用するためのアプローチを示しています。
————————
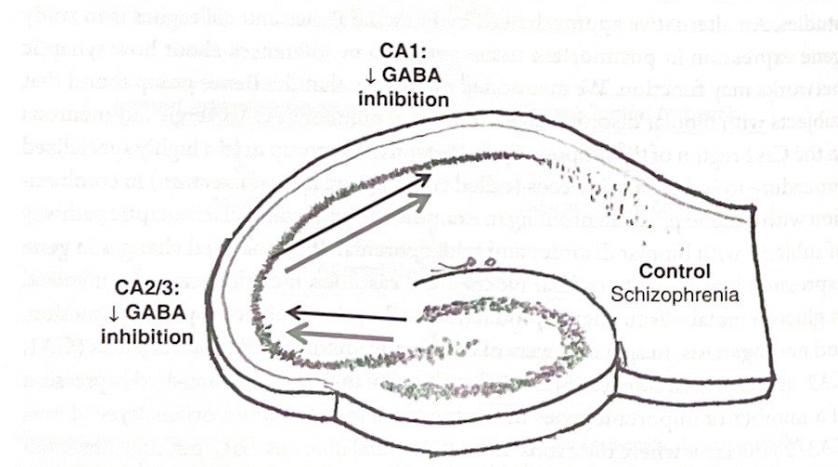
図 7-6 統合失調症と海馬の情報の流れ。この図は、遺伝子発現の変化に基づいて統合失調症患者について提案されている海馬の情報の流れの変化を示しています。 (この数字は、Francine Benes らによって報告されたデータに基づいています。)
————————
高解像度の機能画像法を使用した最近のデータは、統合失調症のリスクがある被験者の CA1 領域の脳血液量が異常に増加していることを示しています。これらの変化は精神病症状の存在と相関しており、ベネスグループが統合失調症で発見した結果を間接的に裏付けるものとなる。さらに、CA1 領域の血液量の変化は、前駆状態 (前精神病) から精神病への進行を予測しました。別の最近の研究では、統合失調症患者の海馬傍回の不活性化が幻聴の発症直前に起こっていることが判明した。これら後者の発見は、海馬への情報流入の変化と一致しており、海馬回路内の機能活動の変化が新しい情報と古い情報を区別する際に問題を引き起こし、その結果症状の発生を引き起こす可能性があることを示唆している。 Carol Tammingaらは、統合失調症における海馬の機能の変化により、歯状回におけるパターン分離が減少するが、CA3領域におけるパターン完成性が向上する可能性があると示唆した。これにより、記憶が不適切に混合され、誤った記憶が呼び戻され、認知エラーが発生する可能性があります。これらの研究を総合すると、海馬機能の変化は精神病の初期に起こり、症状や病気の進行を促進する可能性が高いことを示唆しています。
興味深いことに、海馬は VTA と強い相互関係を持っており、ドーパミンの放出に影響を与えます。統合失調症における海馬の出力の増加は、統合失調症に関連すると考えられるドーパミン作動性活性の増加に寄与する可能性がある。次に、D1 型受容体に作用するドーパミンは、海馬における LTP の固定化を促進します。したがって、ドーパミン放出の強化は、精神病の「記憶」が脳回路にさらに永続的に定着する方法を提供するでしょう。
ここで概説した研究は、健康な人間、精神疾患のある人間、および動物モデルにおいて脳システムがどのように情報を処理するかを調査するためのさまざまなアプローチに焦点を当てています。神経科学、生物医学工学、および遺伝学の進歩は、臨床システムの神経科学に適用できる情報を提供する研究の高度化に貢献しています。これらの進歩は、シナプス生物学と機能的接続性の間の相互関係のより良い理解につながる可能性を秘めています。最終的に、これらの研究は臨床症状や疾患に対する理解を広げるのに役立つはずです。
接続上の欠陥は修正できますか?潜在的な治療標的
ネットワーク分析は、精神科治療における新しい原理を明らかにする可能性を秘めています。たとえば、海馬の異常が認知、感情、動機付けの症状において重要である場合、海馬の機能に影響を与える戦略には治療の可能性があります。齧歯動物のストレスモデルでは、海馬の流入を増強したりCA1の出力を調節したりする治療が有益である可能性があると思われる。これを臨床的に達成する能力は、思われているほど遠い話ではありません。過去 10 年間にわたり、うつ病の多くの治療法が歯状回における新しいニューロンの誕生や成熟を促進することが動物研究で繰り返し示されてきました。この神経新生の亢進は、すべてではないにしても、ほとんどの利用可能な種類の抗うつ薬で観察されますが、抗精神病薬や抗不安薬ではあまり一貫性がありません(またはまったく観察されません)。同様に、電気けいれん療法や迷走神経刺激などの脳刺激方法は神経新生を促進しますが、経頭蓋磁気刺激や脳深部刺激にこの効果があるかどうかは明らかではありません。学習は神経新生も増加させます。心理療法は学習の一形態であるため、神経新生はこの形式の治療の効果に寄与する可能性があります。興味深いことに、自発的な運動や食事(カロリー制限)など、うつ病を助ける可能性のある特定のライフスタイル介入も、歯状神経新生を増加させる可能性があります。ストレスやエタノールなどの薬物乱用など、うつ病を悪化させるいくつかの要因は、神経新生を阻害します。ストレスの軽減と過剰なアルコールの回避は、うつ病患者と神経新生の両方に有益です。
これらの観察は、抗うつ薬の行動効果にとって神経新生が重要であるかどうか、また、そうであれば神経新生が症状の改善にどのように役立つかを調べる研究につながりました。げっ歯類の研究は、歯状神経新生が、抗うつ薬によって引き起こされる行動変化のすべてではなく、一部にとって重要であるという証拠を提供している。レネ・ヘンの研究室は、遺伝子操作と海馬の放射線照射を用いて、新規抑制摂食と慢性的な予測不可能なストレスという2つのマウスモデルにおける抗うつ薬媒介の行動変化には神経新生が必要であることを示した。これらの研究では、新しい細胞の生成を阻害するために海馬への放射線照射が使用されていました。放射線照射自体は、行動や CAI 海馬のシナプス機能に影響を与えませんでしたが、抗うつ薬によって引き起こされる行動の変化を妨げました。ダイセロートの研究室でも、慢性的な軽度のストレスモデルを使用して同様の結果が得られました。これらの研究では、海馬への放射線照射により、強制水泳試験における行動と海馬における電気活動の伝播の変化の両方に対する抗うつ薬の影響が防止された。後者の発見は、慢性ストレスモデルにおけるこの神経系に対する神経新生の影響についての生理学的兆候の可能性を提供する。この研究はまた、ストレスを受けていないラットにおける神経新生の阻害は、「抑うつ」表現型を生成するのに必要でも十分でもないことも示した。これは、神経新生の欠陥自体がうつ病のような行動を引き起こすわけではないことを示唆しています。むしろ、神経新生はネットワークがそれ自体を修復できるメカニズムです。
エリック・カンデルの研究室は、行動介入を利用してこの物語に興味深いひねりを加えました。彼らは、げっ歯類に「安全を学習」させ、悪いこと(ショックなど)が決して起こらない環境にいるときを認識できるようにする方法を検討しました。このタイプの行動条件付けは、強制水泳テストや慢性的な制御不能なストレスのモデルにおいて「抗うつ」効果があります。学習された安全行動によってもたらされる効果の大きさは、抗うつ薬の効果に匹敵しました。歯状神経新生を阻害すると、動物が安全信号を学習する能力と、学習された安全性がストレスモデルでの行動を改善する能力の両方が損なわれた。この結果は、神経発生が学習と、いくつかの形態の心理療法、または少なくとも行動介入の有益な側面の両方に関与している可能性があるという考えを裏付けるものです。他の形式の海馬依存学習(例えば非感情ベースの空間学習)がストレス表現型を助けるのか、それとも嫌悪形式の学習(例えば恐怖条件付け)が神経新生やストレス反応性を妨げるのかはあまり明らかではない。
他の脳領域やネットワークはどうなのでしょうか?
総合すると、上記の研究は、抗うつ薬治療の少なくとも一部の効果には、歯状回における新しいニューロンの誕生と成熟が必要であるという仮説を裏付けるものとなります。しかし、うつ病やその他の障害は単なる海馬の病気ではなく、その生物学には複雑だが完全に理解されていないネットワークが関与していることをすでに強調しました(第 5 章)。この章で海馬を強調したのは、その生物学についてはさらに多くのことが知られており、実際にうつ病やその他の精神疾患に海馬が関与しているためです。また、心のこれらの側面にわたる情報を統合するための重要な拠点としての海馬の役割を考慮すると、病気における海馬の関与は、疾患が認知、感情、動機に影響を及ぼすことをほぼ確実にしていることも強調したいと思います。また、抗うつ薬治療における神経新生の役割は主に海馬中心の現象であるため、神経新生が海馬の生理機能にどのような影響を与えるかを理解することが重要です。
しかし、海馬だけで話は終わりではありません。カンデル研究室とヘン研究室の両方での研究は、抗うつ薬のすべての効果が単に歯状神経新生の増加によって媒介されるわけではないことを強調しています。たとえば、カンデルらは、学習安全行動介入によって扁桃体や他の脳領域における遺伝子発現の変化を発見し、学習安全の回路には背側線条体も関与していることを発見した。したがって、おそらく気分を調節するICNの一部である脳の他の領域がストレスやうつ病においてどのように変化するのかを解明することに大きな関心が寄せられている。一例としては、エリック・ネスラーの研究室での、社会的敗北の齧歯動物モデルにおける不安と抑うつ行動の研究が挙げられる。
これらの研究では、側坐核の殻領域に変化があり、それが特定のカリウムチャネルの機能の変化を介してニューロンの興奮性を変化させることが判明した。これらの変化は、ストレスを受けたマウスが示す不安のような行動と相関しています。これらの研究を超えて、人間の画像研究で強調されているうつ病ネットワークの接続とダイナミクス、特に膝下ACCなどの前頭葉の主要なノードの役割を理解する必要があります。繰り返しになりますが、私たちの重要な点は、うつ病やその他の精神疾患は単一の脳領域の機能不全の産物ではないということです。それらは高次の相互依存する神経回路の問題です。複雑ではありますが、これらのネットワークの生物学は解決可能であり、海馬での研究から得られる教訓は将来の研究のモデルとして役立ちます。
————————
留意事項
海馬は脳機能において重要なノードです。かなりの証拠が、さまざまな精神疾患にわたる海馬の構造と機能の変化を示しています。しかし、海馬は精神疾患の生物学に関与する領域の 1 つにすぎず、特定の精神疾患における機能不全の主な部位ではない可能性があります。それにもかかわらず、海馬は急性および慢性ストレスの影響を非常に受けやすく、これはさまざまな病気に共通するテーマである可能性があります。
精神疾患の理想的な動物モデルはありません。すべてに重大な制限があります。それにもかかわらず、げっ歯類の慢性ストレスと社会的敗北に関する研究は、人間の病気に関連した行動変化に寄与する神経回路と情報処理の問題の一部を解きほぐす方法を提供します。動物モデルは、精神障害の治療の標的となるシナプスおよび分子機構に関する情報も提供します。これらのメカニズムがネットワーク機能にどのような影響を与えるかは、うつ病やその他の障害におけるそれらの役割を理解するために重要です。
歯状回における神経新生は、げっ歯類における抗うつ薬治療の少なくとも一部の行動効果に役割を果たしています。神経新生によってもたらされる可塑性を回収する方法を見つけることは、精神医学における新しく革新的な治療法への潜在的な手段となります。重要なことは、うつ病(または少なくとも齧歯動物におけるストレス表現型)は神経新生の欠陥によって生じるものではなく、神経新生の亢進は海馬ネットワークの機能と行動の改善に役立つということです。薬物療法は歯状神経新生に影響を与える方法の 1 つにすぎず、学習やライフスタイルの変更を利用したリハビリテーションの取り組みは、身体治療の効果を補完または延長することができます。
動物モデルで使用するための洗練された研究ツールが開発されており、そのうちのいくつかは最終的には人間にも利用される可能性があります。これらのツールは、健康と精神疾患において脳領域がどのように相互作用するかについての理解の急速な進歩につながっています。脳への神経系アプローチを理解することは、将来の治療法の開発とメカニズムを理解するために重要です。
————————
推奨される読み物
Airan, R.D.、Meltzer, L.A.、Roy, M.、Gong, Y.、Chen, H.、および Deisseroth, K. (2007)。高速イメージングにより、うつ病の動物モデルにおける行動との神経生理学的関連が明らかになりました。科学、317、819-823。
ルドゥー、J. (2002)。シナプス自己: 私たちの脳がどのようにして私たちになるのか。ニューヨーク:バイキング・プレス。 Santarelli, L.、Saxe, M.、Gross, C.、Surget, A.、Battaglia, F.、Dulawa, S.、他。 (2003年)。抗うつ薬の行動効果には海馬神経新生の必要性。サイエンス、301、805-809。
Sheline, Y.I.、Barch, D.M.、Price, J.L.、Rundle, M.M.、Vaishnavi, S.N.、Snyder, A.Z. 他(2009年)。うつ病におけるデフォルトモードのネットワークと自己言及プロセス。米国科学アカデミー紀要(米国)、106、1942-1947。
その他の参考文献
Adhikari, A.、Topiwala, M.A.、Gordon, J.A. (2010)。不安時の腹側海馬と内側前頭前皮質の間の同期した活動。ニューロン、65、257-269。 Becker, S.、Wojtowicz, J.M. (2006)。記憶障害および気分障害における海馬神経新生のモデル。認知科学の動向、11、70-76。
ベネス、F.M. (2007)。神経回路内の統合失調症および双極性障害の固有のエンドフェノタイプとその分子調節機構の探索。統合失調症速報、33、932-936。
Benes, F.M.、Lim, B.、Matzilevich, D.、Sugguraju, S.、および Walsh, J.P. (2008)。統合失調症患者と双極性障害患者における三シナプス経路の GABA 細胞における回路に基づく遺伝子発現プロファイル。米国科学アカデミー紀要(米国)、105、20935-20940。 Botteron, K.N.、Raichle, M.E.、Drevets, W.C.、Heath, A.C.、Todd, R.D. (2002)。早期発症型うつ病における左膝前前頭前皮質の体積減少。生物学的精神医学、51、342-344。
Bremner, J.D.、Narayan, M.、Anderson, E.R.、Staib, L.H.、Miller, H.L.、および Charney, D.S. (2000)。大うつ病における海馬の体積減少。アメリカ精神医学ジャーナル、157、
115-118。
Campbell, S.、Marriott, M.、Nahmias, C.、MacQueen, G.M. (2004)。うつ病患者における海馬容積の低下:メタ分析。アメリカ精神医学ジャーナル、161、598-607。
Cornwell, B. R.、Salvadore, G.、Colon-Rosario, V.、Latov, D. R.、Holroyd, T.、Carver, F. W.、他。 (2010年)。うつ病患者における海馬機能の異常と空間ナビゲーションの障害:全頭脳磁図による証拠。アメリカ精神医学ジャーナル、167、836-844。
David, D.J.、Samuels, B.A.、Rainer, Q.、Wang, J.-W.、Marsteller, D.、Mendez, I.、他(2009年)。不安/うつ病の動物モデルにおけるフルオキセチンの神経新生依存性および神経新生非依存性の効果。ニューロン、62、479-493。
Diederen, K.M.、Neggers, S.F.、Daalman, K.、Blom, J.D.、Goekoop, R.、Kahn, R.S.、他。 (2010年)。統合失調症における幻聴に先立つ海馬傍回の不活性化。アメリカ精神医学ジャーナル、167、427-435。
Esslinger, C.、Walter, H.、Kirsch, P.、Erk, S.、Schnell, K.、Arnold, C.、他。 (2009年)。ゲノム全体にわたる精神病変異体の神経機構が裏付けられている。科学、324、605。
Famy, C.、Streissguth, A.P.、Unis, A.S. (1998)。胎児性アルコール症候群または胎児性アルコールの影響を伴う成人の精神疾患。アメリカ精神医学ジャーナル、155、552-554。 Frodl, T.、Meizenzahl, E.M.、Zetzsche, T.、Born, C.、Groll, C.、Jager, M.、他。 (2002年)。大うつ病の最初のエピソードを持つ患者の海馬の変化。アメリカ精神医学ジャーナル、
159、1112-1118。
Frodl、T.S.、Koutsouleris、N.、Bottlender、R.、Born、C.、Jager、M.、Scupin、I.、他。 (2008年)。 3年間にわたるうつ病に関連した脳形態の変化。一般精神医学のアーカイブ、
65、1156-1165。
Gilbertson、M.W.、Shenton、M.E.、Ciszewski、A.、Kasai、K.、Lasko、NB、Orr、S.P.、他。 (2002年)。海馬の容積が小さいと、心理的外傷に対する病理学的脆弱性が予測されます。 Nature Neuroscience、5、1242-1247。
Gorwood, P.、Corruble, E.、Falissard, B.、Goodwin, G.M. (2008)。脳機能に対するうつ病の有害な影響: うつ病の外来患者の大規模サンプルにおける、遅発性想起の障害とうつ病障害の累積期間。アメリカ精神医学ジャーナル、165、
731-739。
Grimm, S.、Boesiger, P.、Beck, J.、Schuepbach, D.、Bermpohl, F.、Walter, M.、他。 (2009年)。うつ病の被験者の感情処理中に、デフォルトモードネットワークの否定的な太字の反応が変更されました。神経精神薬理学、34、932-943。
ハリソン、P.J. (2002)。原発性気分障害の神経病理学。 Brain、7、1428-1449。 Hercher, C.、Turecki, G.、Mechawar, N. (2009)。鏡を通して:大うつ病における細胞変化の神経解剖学的証拠を調べる。精神医学研究ジャーナル、43、947-961。
和泉洋、北林良、船津正、和泉正、湯出千、ハートマンR.E.、他(2005)。開発中に 1 日エタノールにさらされると、双方向可塑性、NMDA 受容体機能、およびエタノール感受性に対して持続的な影響が生じます。神経科学、136、269-279。ケンパーマン、G. (2008)。神経原性予備能仮説: 成人の海馬の神経新生は何に役立つのでしょうか?神経科学の動向、31、163-169。
Lisman、J.E.、Coyle、J.T.、Green、R.W.、Javitt、D.C.、Benes、F.M.、Heckers、S.、他。 (2008年)。統合失調症における神経伝達物質とリスク遺伝子の相互作用を理解するための回路ベースのフレームワーク。神経科学の動向、31、234-242。
Nestler, E.J.、Barrot, M.、DiLeone, R.J.、Eisch, A.J.、Gold, S.J.、Monteggia, L.M. (2002)。うつ病の神経生物学。ニューロン、34、13-25。
J. W. オルニー、C. ヤング、D. F. ウォズニアック、V. ジェフトヴィッチ・トドロヴィッチ、C. イコノミドゥ (2004)。小児用の薬は発達中のニューロンを自殺させるのでしょうか?薬理学の動向、25、135-139。
Peterson, B.S.、Warner, V.、Bansal, R.、Zhu, H.、Hao, X.、Liu, J.、他。 (2009年)。大うつ病の家族性リスクが高い人の皮質の薄化。米国科学アカデミー紀要(米国)、106、6273-6278。
ピッテンジャー、C.、およびデューマン、R.S. (2008)。ストレス、うつ病、神経可塑性: 収束メカニズム。神経精神薬理学、33、88-109。
ポラック D.D.、モンジェ F.J.、ザッカーマン L.、デニー J.A.、ドリュー M.R.、カンデル E.R. (2008)。
うつ病に対する行動介入の動物モデル。ニューロン、60、149-161。レイクル、M.E.、スナイダー、AZ (2007)。脳機能のデフォルトモード: 進化するアイデアの簡単な歴史。ニューロイメージ、37、1083-1090。
ローガン、M.T.、レオン、K.S.、ペレス、D.L.、カンデル、E.R. (2005)。マウスの扁桃体と線条体における安全性と危険性を示す明確な神経サイン。ニューロン、46、309-320。サヘイ、A.、ヘン、R. (2007)。うつ病における成人海馬の神経新生。ネイチャーニューロ- 科学、10、1110-1115。
サポルスキー、R.M. (2000)。精神神経疾患における糖質コルチコイドと海馬萎縮。一般精神医学アーカイブ、57、925-935。
Schobel, S.A.、Lewandowski, N.M.、Corcoran, C.M.、Moore, H.、Brown, T.、Malaspina, D.、他。 (2009年)。統合失調症および関連する精神病性障害による海馬形成の CA1 サブフィールドの異なる標的化。一般精神医学アーカイブ、66、 938~946。
スミス、M.E. (2005)。外傷後ストレス障害の成人における両側海馬容積の減少:構造的 MRI 研究のメタ分析。海馬、15、798-807。 Sheline, Y.、Gado, M.H.、および Kraemer, H.C. (2003)。未治療のうつ病と海馬の体積減少。アメリカ精神医学ジャーナル、160、1516-1518。
Sheline, Y.、Sanghavi, M.、Mintun, M.、および Gado, M. (1999)。大うつ病を再発した女性の海馬容積の減少は、年齢ではなくうつ病の期間によって予測されます。神経科学ジャーナル、19、5034-5043。
Sheline, Y.、Wang, P.、Gado, M.、Csernansky, J.、Vannier, M. (1996)。再発性大うつ病における海馬萎縮。米国科学アカデミー紀要(米国)、93、3908-3913。
Shi, F.、Liu, B.、Zhou, Y.、Yu, C.、Jiang, T. (2009)。軽度認知障害およびアルツハイマー病における海馬の体積と非対称性: MRI 研究のメタ分析。海馬、19、1055-1064。
Sigurdsson, T.、Stark, K.L.、Karayiorgou, M.、Gogos, J. A.、および Gordon, J. A. (2010)。統合失調症の遺伝的マウスモデルにおける海馬と前頭前野の同期性の障害。自然, 464,
763-767。
Song, H.、Stevens, C.F.、および Gage, F.H. (2002)。成人の海馬からの神経幹細胞は、機能的なCNSニューロンの必須の特性を発達させます。 Nature Neuroscience、5、438-445。タミンガ、C.A.、スタン、AD、ワグナー、AD (2010)。統合失調症における海馬の形成。アメリカ精神医学ジャーナル、167、1178-1193。
Videbech、P.、Ravnkilde、B. (2004)。海馬の体積減少と低下:MRI 研究のメタ分析。アメリカ精神医学ジャーナル、161、1957-1966。 Vythilingam、M.、Heim、C.、Newport、J.、Miller、A.H.、Anderson、E.、Bronen、R.、他。 (2002年)。大うつ病の女性における海馬容積の減少に関連する幼少期のトラウマ。アメリカ精神医学ジャーナル、159、2072-2080。
Wallace, D.L.、Han, M.-H.、Graham, D.L.、Green, T.A.、Vialou, V.、Iniguez, S.D. 他(2009年)。 CREB による側坐核の興奮性調節は、社会的孤立によって誘発される行動障害を媒介します。 Nature Neuroscience、12、200-209。
ウォーレン・シュミット、J.L.、およびデューマン、R.S. (2006)。海馬の神経新生: ストレスと抗うつ剤治療の相反する効果。海馬、16、239-249。
Whitfield-Gabrieli, S.、Thermenos, H. W.、Milanovic, S.、Tsuang, M. T.、Faraone, S. V.、McCarley, R. W.、他(2009年)。統合失調症および統合失調症患者の第一親等におけるデフォルトネットワークの活動亢進および過剰接続。米国科学アカデミー紀要(米国)、106、1279-1284。
Wright, I.C.、Rabe-Hesketh, S.、Woodruff, P.W.、David, A.S.、Murray, R.M.、Bullmore, E.T.
(2000年)。統合失調症における局所的な脳容積のメタ分析。アメリカ精神医学ジャーナル、157、16-25。
ゾルムスキー、C.F. (2005)。神経生物学、神経新生、および精神病理学の病理学。 CFではZorumski & E. H. Rubin (編)、ゲノムと神経科学時代の精神病理学 (pp. 175-187)。ワシントン DC: アメリカ精神医学出版。

