9 血管性認知症
-------------
重要な概念
・血管性認知症(VaD)は認知症の中で2番目に多いタイプです。 VaD は脳卒中による脳損傷によって引き起こされます。
・皮質VaDは通常、大きな脳血管の発作によって引き起こされます。症状は脳卒中の発生部位によって異なります。
・皮質下VaDは通常、小さなラクナ梗塞と白質虚血によって引き起こされます。その症状には、前頭神経回路および/または皮質下の神経回路の損傷による前頭葉障害が含まれます。
・VaDの治療には、アセチルコリンエステラーゼ阻害剤による脳卒中の危険因子の軽減とコリン作動性機能の増強が含まれます。
-------------
以前は多発梗塞性認知症として知られていた VaD は、アルツハイマー病 (AD) に次いで 2 番目に多い認知症の形態であり、認知症患者の 25% もの患者が罹患しています。 VaD は臨床的には AD に似ているかもしれませんが、その病因は異なります。これは、脳血管疾患の結果として生じる局所的またはびまん性の皮質または皮質下の脳損傷によって引き起こされます。 VaD の二次的な原因は、心血管イベント (心房細動などの不整脈中に発生する塞栓) または頸動脈アテローム性プラークから生じる塞栓性脳卒中です。この病因を考慮すると、脳スキャンでの血管病変の存在は、VaD の重要な診断特徴を表します。 VaD の有病率は脳卒中の発生率と結びついています。その結果、VaD の割合は 60 歳から 90 歳を超えるまでに 200 倍近く増加し、AD との顕著な重複が含まれます。 VaD のリスクが最も高い個人は、アテローム性動脈硬化、高血圧、高脂血症、不整脈、糖尿病 (DM)、および喫煙の病歴を持ち、脳卒中のリスクがある人々です。驚くべきことではないが、脳卒中の予防と治療の改善の結果、VaD の有病率は低下した。
-------------
臨床ビネット
アンソニー氏は 75 歳の広告会社幹部で、糖尿病、冠状動脈性心疾患、高血圧を患っており、葉巻を吸うことが好きでした。ユタ州へのスキー旅行中に脳卒中を起こし、右半身麻痺と軽度の失語症を患った。積極的なリハビリテーションにより、彼は杖を使って歩くことができ、言葉を見つけるのが軽度に困難になるだけでコミュニケーションが取れるようになりました。しかし、脳卒中から 4 か月後、彼の妻は、彼の短期記憶が弱く、怒りの発作を起こしやすいと報告しました。脳卒中から6か月後、アンソニー氏は口座管理ができなくなったため退職を余儀なくされた。うつ病の治療により彼のイライラは軽減されましたが、認知障害は残りました。アンソニーさんは食事と血圧をコントロールすることができましたが、喫煙は続けました。脳卒中から2年後、彼は再び脳卒中を患い、重度の失語症になり、歩くことができなくなった。理学療法および作業療法により身体的には中程度の改善が見られましたが、認知力は依然として低いままでした。
-------------
*診断基準
VaD では、次の 2 つの診断基準が一般的に使用されます。精神障害の診断と統計マニュアル、第 4 版、テキスト改訂基準、および国立神経障害・脳卒中協会国際研究所 (Recherche et l’Enseignement en Neurosciences) NINDS-AIREN) の基準。これらをそれぞれ表 9.1 および 9.2 に示します。どちらのセットも、脳血管疾患の存在または脳卒中の発生と認知症症状の発症との関係に焦点を当てています。 NINDS-AIREN 基準も診断の確率を考慮します。
*脳卒中の関連性
毎年、米国では推定 500,000 人から 700,000 人が脳卒中を患っています。このうち、3か月後には約25%から30%が認知症を発症し、ADの新規症例が年間約36万人であるのに対し、VaDの新規症例は12万5,000人に相当することが研究者らによって判明した。 4 つのタイプの脳血管障害または脳卒中が発生する可能性があり、すべてが VaD に関連しています。これらには次のものが含まれます。
1. 血栓性: これは最も一般的な脳卒中の形態です。組織の梗塞または死は、アテローム性プラークの蓄積によって引き起こされる脳内の動脈の血栓症または閉塞によって起こります。
2. 塞栓性: 脳組織への損傷は、アテローム性物質の破片や塞栓、あるいは頸動脈や心臓からの血栓による動脈の閉塞によって生じます。塞栓性イベントは全脳卒中の 3 分の 1 を占めます。 3. ラクナ:これらは小さな脳卒中であり、明白な臨床症状を欠く場合もあり、脳のより深い非皮質領域にある小さな貫通脳動脈の閉塞によって引き起こされます。それらは全ストロークの 5 分の 1 に相当します。 4. 出血性:これは最も重篤ですが頻度が最も低いタイプの脳卒中で、通常は動脈瘤破裂または動静脈奇形の結果として生じる脳内の出血による脳損傷を引き起こします。これらは一般に高血圧または抗凝固療法に関連しています。脳卒中の種類に関係なく、特定の脳卒中の結果は予測できません。しかし、左側に病変があると認知症の可能性が大幅に増加します。 50 ~ 100 cm3 を超える組織死。嚥下障害、歩行障害、尿失禁などの脳卒中の症状。発作、不整脈、肺炎、低血圧などの脳卒中合併症。脳機能のより影響力の大きい領域に影響を与える脳卒中は、特に以前の脳卒中や他の傷害による既存の損傷が存在する場合、VaD を引き起こす可能性が高くなります。さらに、脳卒中後の認知症のリスク増加は、高齢、教育および収入レベルの低下、非白人の人種/民族、喫煙、肥満、認知症の家族歴、冠動脈疾患、高血圧、心臓病の病歴と関連しています。そしてDM。 VaDのリスクが6倍に増加する最も高いリスクグループは、高血圧と糖尿病の両方を患っている人です。
-------------
表9.1.精神障害の診断と統計マニュアル、第 4 版、本文改訂、血管性認知症の基準


-------------
-------------


表9.2.
-------------
*血管性認知症の分類
VaD は、血管損傷の種類、位置、時間経過に基づいていくつかの方法で分類できます。血管損傷の種類による分類には次のものがあります。
・大血管疾患によるVaD:脳卒中は、前大脳動脈、後大脳動脈、中大脳動脈の分布など、広い組織領域に影響を及ぼします。
・小血管疾患による脳卒中:小さな脳卒中、特に裂孔で、損傷が蓄積します。
あるレビューでは、VaD の全症例の半数は小血管疾患によるもので、症例の 4 分の 1 は皮質領域と皮質下領域の両方における大血管病変によるもので、残りは両方の要素を含んでいた。影響を受ける最も一般的な動脈は中大脳です。
血管損傷の位置による分類には、皮質 VaD と皮質下 VaD が含まれます。皮質損傷は通常、血栓症と関連しますが、塞栓性イベントや出血性イベントとはそれほど関連しません。あまり一般的ではありませんが、皮質損傷を引き起こす可能性のある脳血管以外の事故には、静脈血栓症、低灌流、外傷、びまん性微小梗塞などがあります。皮質下 VaD は通常、大脳基底核、視床、橋、および周囲の白質路の領域における多発性ラクナ梗塞の存在と関連しています。この変異は、単にラクナ状態と呼ばれることもあります。
VaD を分類する 3 番目の方法は、急性か亜急性かの時間経過によるものです。急性発症の VaD は、臨床的に明らかな脳卒中後に発生し、単一または再発性の皮質および皮質下のイベントが含まれる場合があります。亜急性 VaD は通常、臨床的脳卒中との明らかな時間的関連性がなく、変動する経過を伴う進行性認知症を伴う皮質下症候群を指します。
*血管性認知症の臨床症状
理論的には、VaD の臨床症状は脳損傷の部位を反映しているはずです。しかし、脳内の神経接続は複雑であるため、実際に症状と解剖学的病変を関連付けることが困難になることがよくあります。したがって、臨床診断において行うべき最も実際的な区別は、VaD の皮質型と皮質下型の区別です。
皮質性VaDには主に記憶機能障害と、失行症、失語症、失認症、実行機能障害のうちの1つ以上が含まれます。関連する神経障害は、ほとんどの場合、病変の対側の片麻痺または麻痺によって特徴付けられます。皮質損傷による認知障害の正確な形態は、まず優位半球が影響を受けるか非優位半球が影響を受けるかによって決まり(ほとんどの人は左半球が優位です)、次に次のように影響を受ける特定の葉に依存します:前頭葉、頭頂葉、後頭葉。 、そして時間的。表 9.3 は、皮質機能障害の臨床症状と既知の損傷領域を関連付けるための一般的なガイドを示しています。
-------------
表9.3.皮質脳卒中の認知的影響




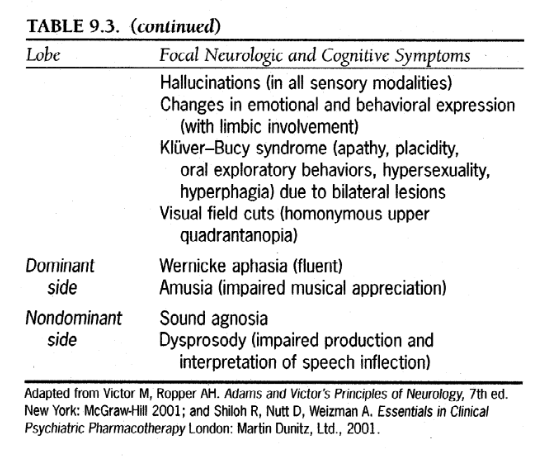

Victor M、Ropper AH から転載。アダムスとビクターの神経学の原則、第 7 版。ニューヨーク: マグロウヒル 2001;および Shiloh R、Nutt D、Weizman A. ロンドンの臨床精神医学的薬物療法の要点: Martin Dunitz, Ltd.、2001 年。
-------------
-------------
臨床ビネット
スチュアート氏は 85 歳の男性で、右側頭頂部脳卒中を患い、その結果として左側半身麻痺を患いました。彼はリハビリ施設に入院して理学療法と作業療法を受けたが、症状の進行は遅かった。主に、これは彼が左側を無視し、病態失認として知られる、何か問題があることを否定したことが原因でした。彼は自分で服を着ることができず、視空間能力も貧弱でした。彼は理学療法に全面的に参加することを拒否し、問題を常に否定していたので、最終的には老人ホームへの入所につながりました。
-------------
皮質下 VaD は、大脳基底核、視床、内包など、皮質の下にある脳の多数の領域にさまざまな影響を及ぼします。大脳基底核は運動運動の調整において中心的な役割を果たしており、被殻、淡蒼球、尾状核、およびいくつかの脳幹核が含まれています。視床は部分的に、末梢神経系、大脳基底核、皮質領域からの運動と情報の両方を統合するいくつかの核で構成されています。視床の正背核は、海馬構造とともに、脳の重要な記憶処理中枢です。複雑な神経フィードバック ループが前頭皮質、大脳基底核、視床の間に存在し、運動運動、認知速度、気分、衝動制御、モチベーションの統合と調節を助けています。これらの関連性により、皮質下 VaD の典型的な臨床症状が反映しているように、皮質下の損傷は前頭葉の機能に直接影響します。これらには実行機能障害が含まれます。記憶機能障害、特に記憶想起障害。注意欠陥。思考処理の低下(徐脈)。パーキンソニズム(固縮、運動緩慢、歩行の遅さ)。運動障害。構音障害;無関心;そしてうつ病。
大脳基底核構造への特定の損傷は、振戦、固縮、運動緩慢、姿勢不安定、および不随意運動(例、ジストニア、ジスキネジア、舞踏病、アテトーゼ)を含むさまざまな形態の運動障害を引き起こす可能性があります。視床損傷は、濃厚な感覚喪失に反映される可能性があります。内部被膜内の隣接する皮質運動路に付随的な損傷が発生すると、片麻痺を伴います。一部の視床核の損傷は、重度の前向性健忘、洞察力の欠如、および作文を特徴とするコルサコフ症候群(または視床性健忘症)などの記憶障害を引き起こす可能性もあります。
脳アミロイド血管症(CAA)は、脳血管内でのベータアミロイドタンパク質の沈着を特徴とする一連の疾患で、再発性脳葉出血、虚血性脳卒中、進行性認知症を引き起こします。皮質症状と皮質下症状の両方が考えられます。 CAA には、常染色体優性遺伝を伴ういくつかの異なる家族型が存在します。 CAAは、すべての脳葉出血の最大30%を占める可能性があり、AD患者の大部分に見られます。
*皮質下血管性認知症のサブタイプ
皮質下 VaD には主に次の 2 つの形態があります。
*ビンスワンガー病は、皮質下動脈硬化性脳症または虚血性心室周囲白質脳症としても知られ、慢性高血圧を伴うゆっくりと進行する認知症です。これは、皮質下領域の小さな貫通血管の損傷を特徴とし、その結果、一時的な低灌流と白質変性が生じます。
*CADASIL(皮質下梗塞および白質脳症を伴う常染色体優性脳動脈症)は、19番染色体上のNotch 3遺伝子の変異にマッピングされる常染色体優性疾患で、成人にゆっくりと進行する認知症を引き起こし、通常40代半ばで発症します。これには、細動脈と毛細血管に影響を与える微小血管障害プロセスが関与しており、皮質下構造全体に小さな虚血性梗塞が生じます。 CADASIL は 20 年以上にわたって進行する可能性があり、認知症に加えて、一過性虚血発作や脳卒中、局所的な神経症状、頭痛、気分障害、発作を伴います。 CADASIL に関連する認知症は、精神処理速度の顕著な低下と実行機能と注意力の欠如を特徴としています。後期ではビンスワンガー病によく似ています。
-------------
臨床ビネット
リンさんは 72 歳のタクシー運転手で、高血圧症の病歴がありました。彼は、ろれつが回らなくなったり、手の制御が困難になったりするエピソードを数回報告したが、それぞれの症状は数分しか続かなかった。しかし、あるエピソードでは、彼は不安定な運転のために警察に止められ、警察官にはっきりと言葉を発することができなかったため、病院に送られました。医学的および神経学的精密検査により、ラクナ梗塞が明らかになりました。タクシー運転手の仕事を辞めざるを得なくなったが、配車のアルバイトを始めた。しかし、その後 12 か月間で、リン氏は物忘れが増加し、運動機能が低下することがわかりました。彼はますます仕事を管理できなくなったため、解雇されました。再診で主治医はパーキンソン病を疑ったが、レボドパの試験は効果がなかった。リンさんはますます憂鬱になり、一日のほとんどを家でテレビの前に座って過ごすようになりました。抗うつ薬は彼の気分を改善するのに役立ったが、彼の妻は、ボウリングや近くの球場での野球の試合を見に行くなど、彼の好きな趣味を追求する意欲が欠けていると指摘した。
-------------
パーキンソニズムまたはその他の運動障害の存在は、通常、皮質下の損傷と実際の前頭葉またはその他の皮質性認知症とを区別するのに最も役立つ症状です。しかし、第 1 章で指摘したように、皮質認知症と皮質下認知症の区別は、皮質と皮質下の神経結合が密接であるため、人為的であると批判されている。皮質性認知症と皮質下性認知症の違いは、第 1 章の表 1.2 にまとめられています。
-------------
キーポイント
脳にはそれ自体が存在する部分はないということに留意してください。皮質と皮質下の両方の脳領域間の無数の神経接続は、いずれかの部分の損傷が他の多くの部分に影響を与えることを意味します。神経心理学的検査で特定の所見が得られたり、脳スキャンで特定の病変が特定されたにもかかわらず、その後の臨床像を予測するのは依然として難しい場合があります。
-------------
表9.4.ハチンスキー虚血スケール
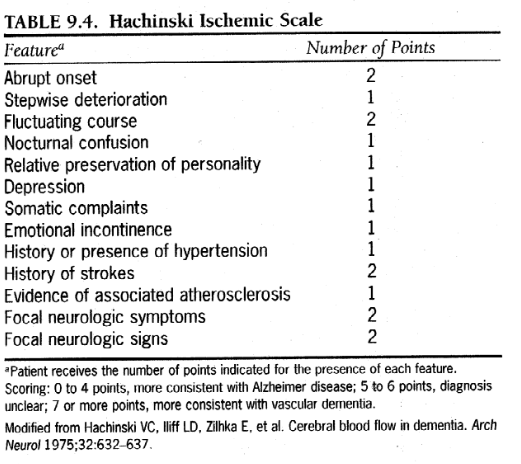

*患者は、各特徴の存在に対して示されたポイント数を受け取ります。スコア: 0 ~ 4 ポイント、アルツハイマー病とより一致。 5~6点、診断は不明瞭。 7 点以上、血管性認知症とより一致します。 Haschinski VC、Illiff LD、Zilhka E らから変更。認知症における脳血流。アーチ ニューロール 1975;32:632-637。
-------------
*評価と鑑別診断
VaD の評価は第 1 章から第 5 章で概説した手順に従いますが、診断では神経画像検査に重点が置かれます。しかし、VaD と AD の区別は困難な場合があります。なぜなら、この 2 つの実体は臨床的に区別できないように見えることがあり、混合型認知症と呼ばれる状態で同時に発生することが多いためです。臨床医は認知症の症状をVaDの脳卒中と関連付けようとしているという事実にもかかわらず、単一の事象ではなく蓄積された脳血管損傷のプロセスが多くの症例の原因となっている可能性がある。したがって、VaD は AD と同様にゆっくりと進行することが多いようです。研究者たちは、この 2 つの臨床実体間の関係にますます注目するようになりました。たとえば、脳の血管損傷はアルツハイマー病のリスクが高く、経過が悪化することに関連しており、VaD とアルツハイマー病の両方が中枢性コリン作動性欠損を引き起こす可能性が高い。肉眼的な病理学的レベルでは、アルツハイマー病患者の脳スキャンでは小さな脳卒中や白質病変が頻繁に明らかになります。顕微鏡レベルでは、老人斑と神経原線維変化はどちらの疾患でも見られますが、AD ではそれらの密度が著しく高くなります。
これらの類似点にも関わらず、以下のいくつかの要因は、VaD の診断をより示唆しています: 局所的な神経学的障害 (歩行障害や尿失禁を含む)、複数の血管危険因子、神経画像検査で見られる脳病変、より変化しやすく進行性の低い経過 (すなわち、変動する、段階的な悪化)、より大きな実行機能障害、およびそれほど顕著ではない記憶機能障害。これらの違いは、表 9.4 に示すように、各変数にスコアを割り当てるハッチンスキー虚血スケールに部分的に含まれます。スコアが高いほど、VaD との一致性が高くなります。ハチンスキー虚血スケールに関する情報の多くは、臨床面接と神経学的検査によって得ることができます。神経心理学的プロファイルは、AD で見られる全体的な機能障害の傾向と比較して、斑点状の障害を明らかにすることで、VaD を特定するのに役立つ可能性があります。これは確かに、大規模な離散的な皮質梗塞の場合に当てはまります。しかし、神経心理学的検査に関するある包括的なレビューでは、VaDとAD患者を区別する2つの領域のみが、前頭葉実行機能障害の障害が大きく、言語的長期記憶の障害が少ないことが判明した。
*ニューロイメージング
コンピューター断層撮影法 (CT) や磁気共鳴画像法 (MRI) などの神経画像検査は、VaD につながる大きな脳卒中を特定するのに役立ちますが、脳萎縮、心室拡大、および小規模またはより広範な皮質損傷の存在が原因となる可能性があります。解釈がさらに難しくなります。白質信号強度亢進は、MRI で見られる一般的な皮質下の所見で、VaD や AD を含む高齢者の 30% ~ 80% の脳に現れます。それらの正確な性質については議論の余地がありますが、虚血性損傷の小さな領域を表していると考えられています。ただし、それらが存在する場合でも、必ずしも認知障害と関連しているわけではありません。グルコース利用を介して脳機能を調べる陽電子放射断層撮影法(PET)スキャンの所見は、AD における側頭頭頂部代謝低下と比較して、VaD ではより散在性の欠損が明らかになる傾向があります。
*処理
他の形態の認知症と同様、早期の診断と治療が重要ですが、VaD では、脳への血管損傷を軽減したり、さらにはそれ以上の損傷を阻止したりする可能性があるため、早期診断と治療がより大きな役割を果たす可能性があります。 VaD 患者には脳卒中のリスクが高くつき、AD と比較して罹患率と死亡率が時間の経過とともに増加します。たとえば、ある研究では、VaD患者の5年後の死亡率は約60%で、AD患者の死亡率の2倍でした。 VaD の治療には、次のようないくつかの手順が含まれます。
・高リスク患者における脳卒中の一次予防。
・すでに脳卒中を患っている患者の再発の二次予防。
・神経保護剤の使用を考慮する。
・アセチルコリンエステラーゼ(AChE)阻害剤の使用。
・グルタミン酸受容体拮抗薬の使用。
一次予防は、高リスクの人における脳卒中の可能性を減らすことを目的としています。リスクを軽減する可能性のあるライフスタイル要因には、定期的な運動、バランスの取れた食事の維持、肥満の軽減、タバコ製品の回避などが含まれます。血圧(BP)と血糖値のコントロールが鍵となります。おそらく最適な血圧ウィンドウが存在します。ある研究では、VaD患者の小規模コホートにおいて、収縮期血圧を135~150mmHgに維持することが認知の安定化と関連していた。多くの人は、心筋梗塞や脳卒中のリスクを軽減するためにアスピリンを毎日服用しており、コレステロール値を下げ、おそらくは他の心臓血管への利益を得るためにスタチン系薬剤も服用しています。実際、これらの介入の多くは脳卒中のリスクを 30% も減らすことができます。過剰なホモシステインレベルが心血管疾患(およびアルツハイマー病 – 第 7 章を参照)に関係しているという最近の発見を考慮して、多くの医師も予防戦略として葉酸の補給を推奨し始めています。
二次予防は、以前のイベント後の脳卒中再発のリスクを修正することを目的としており、一次予防に挙げられたすべての戦略が組み込まれています。心房細動などの慢性不整脈の場合、脳卒中のリスクを軽減するには抗凝固療法が必要であり、ワルファリン(クマジン)の使用によりリスクが70%低下します。頸動脈内膜切除術は、重度の頸動脈による脳卒中のリスクを軽減できる可能性があります。狭窄。脳卒中予防のもう 1 つの定番は、アスピリン、チクロピジン (Ticlid)、クロピドグレル (Plavix)、シロスタゾール (Pletal)、およびジピリダモール (Persantine) などの抗血小板薬の使用です。ペントキシフィリン (Trental) は血液粘度を低下させ、赤血球の柔軟性を改善します。
-------------
ヒント
血管危険因子の見直しは、すべての認知症精密検査の一部として行う必要があります。 VaD が疑われる場合、または個人に脳卒中または複数の危険因子の病歴がある場合、適切な治療を開始し、ライフスタイルの変更を推奨するために、患者の内科医および/または神経内科医の関与が重要です。高血圧、頸動脈狭窄、一過性脳虚血発作などの危険因子が発生した場合に、様子を見て待つという選択肢は決してありません。
-------------
*神経保護剤
長年にわたり、脳機能に対する保護効果または増強効果があると考えられているいくつかの薬剤が、VaD の治療に使用されてきました。ニモジピン(ニモトップ)やニカルジピン(カルデン)などのカルシウムチャネル遮断薬は、脳血流の改善に役立つ可能性があります。エルゴロイドメシル酸塩(ヒデルギン)と麦角誘導体ニセルゴリン(セルミオン)は血管拡張剤として作用すると考えられており、抗酸化特性もある可能性があります。イチョウ葉にはさまざまな潜在的なメカニズムがありますが、ワルファリンや抗血小板薬と一緒に摂取すると出血のリスクが高まる可能性もあります。いくつかの向知性薬(「心に作用する」)薬には、神経膜リン脂質の合成を活性化すると考えられているシチジンジホスホコリン(シチコリン)や、ピラセタムやオキシラセタムなどのアミノ酸化合物群が含まれます。残念ながら、これらの薬剤はいずれも VaD に対する有効性が十分に確立されていないため、現在推奨される治療選択肢ではありません。エルゴロイドメシル酸塩とイチョウ葉の詳細については、第 8 章を参照してください。
*アセチルコリンエステラーゼ阻害剤
最近の研究では、ドネペジル (アリセプト)、リバスチグミン (エクセロン)、ガランタミン (ラザダイン ER) などの AChE 阻害剤の使用により、VaD の認知、機能、さらには行動の改善が実証されています。 VaD 患者で改善された行動指標には、無関心、不安、過敏性、うつ病、さらには精神病が含まれていました。これらの所見を考慮すると、AD と VaD の両方には、AChE 阻害剤療法で改善できる中枢性コリン作動性欠損が関与している可能性があります。これらの薬剤のメカニズムと投与戦略については、第 8 章で詳しく説明します。
*グルタミン酸受容体拮抗薬
メマンチン (Namenda) は、中等度から重度の段階の AD を治療するために食品医薬品局 (FDA) に承認されている N-メチル-D-アスパラギン酸 (NMDA またはグルタミン酸) 受容体拮抗薬です。 2つの臨床試験では、メマンチンで治療されたVaD患者は、プラセボ群と比較して28週間にわたって相対的な認知安定性を維持した。臨床現場では、メマンチンは一般に AChE 阻害剤と組み合わせて処方されます。メマンチンについては、投与方法も含めて第 8 章で詳しく説明します。
*精神障害
VaD によく見られる行動障害には、無関心、うつ病、不安、感情失禁、二次躁病 (脳卒中、特に右側の病変による)、興奮、精神病などがあります。これらの障害の評価と治療については、第 13 章、第 14 章、および第 15 章で詳しく説明されています。

